THE izomerija to je fenomen koji se opaža kada različite spojeve tvore jednake količine istih vrsta atoma.
Stoga možemo pronaći kemijske tvari s istom molekularnom formulom i različitim strukturnim formulama ili prostornim rasporedom.
Ovaj se fenomen naširoko promatra u organskoj kemiji, koja proučava spojeve ugljika. Kako svaki atom ovog elementa može napraviti 4 kemijske veze, moguće je promatrati različite kombinacije.
Kako promjena u rasporedu atoma stvara nove tvari, posljedično, one imaju različita fizikalna i kemijska svojstva.
Kad kažemo koji su spojevi izomeri znači da imaju jednake dijelove, jer je riječ kombinacija dva pojma grčkog porijekla: isos, znači "stvarno", i puko, što je "dijelovi".
Dvije glavne skupine izomerizma su ravnina i prostor (stereoizomerizam).
THE plosnati izomerizam može se vizualizirati ravnom strukturnom formulom spojeva i ima pet klasa: položaj, funkcija, lanac, kompenzacija i tautomerija.
THE izomerija prostora promatra se prema orijentaciji spojeva i dijeli se na geometrijsku (cis-trans) i optičku.
Pojam izomerizma uveo je 1830. švedski znanstvenik Jacob Berzelius.
Primjeri izomera
THE lančana izomerija događa se kada se isti skup atoma poveže u strukture iste funkcionalne skupine, ali s različitim lancima.
Primjer: molekulska formula C4H10 ugljikovodika mogu biti ravni ili razgranati.

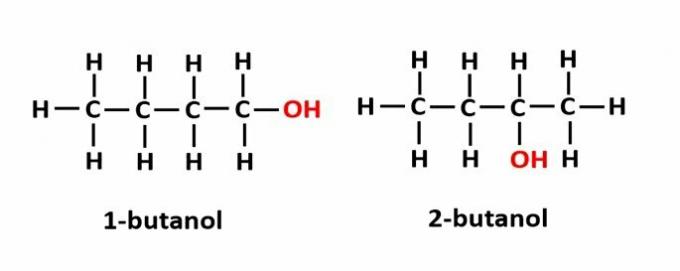
THE položajni izomerizam nastaje kada spojeve tvore iste funkcionalne skupine, ali su na različitim pozicijama u lancu.
Primjer: Molekularna formula C4H9OH odgovara dvije vrste alkohola.
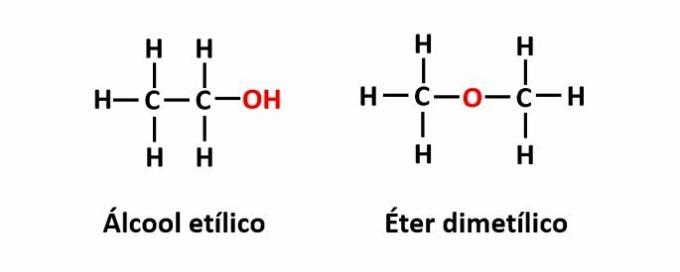
THE izomerija funkcije nastaje kada ista molekulska formula odgovara dvama spojevima s različitim funkcionalnim skupinama.
Primjer: Molekularna formula C2H6O odgovara dvama izomerama koji imaju funkciju alkohola (-OH) i etera (-O-).
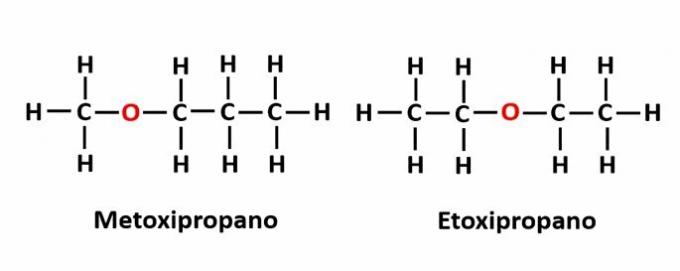
THE kompenzacijski izomerizam javlja se kada se u lancu nalazi heteroatom i on zauzima različite položaje. Ovo je poseban slučaj izomerizma položaja.
Primjer: Molekularna formula C4H10Označava prisutnost atoma kisika u lancu, ali se njegov položaj može promijeniti i formirati različite spojeve.
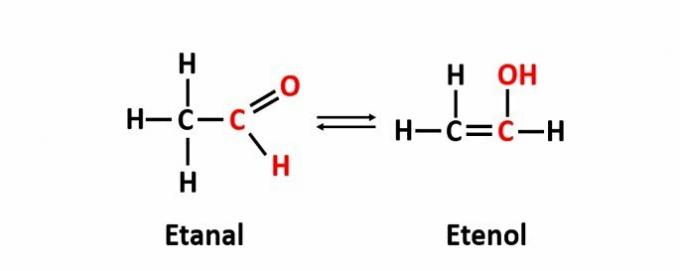
THE dinamički izomerizam, također nazvana tautomerija, događa se kada su dva spoja s različitim funkcijama u istoj otopini u dinamičkoj ravnoteži. Ovo je poseban slučaj izomerizma funkcije.
Primjer: Molekularna formula C2H4O odgovara spojevima s aldehidnim i enolnim funkcijama.
Nauči više o plosnati izomerizam.
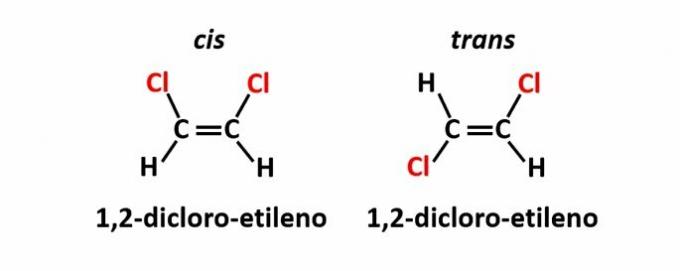
THE geometrijski izomerizam, također se naziva izomerija cis-trans, događa se kada prisutnost dvostruke veze ili cikličke strukture uzrokuje da se jednaki ligandi nalaze na istoj strani ravnine (cis) ili na suprotnim stranama (trans).
Primjer: atomi klora u spojevima molekularne formule C2H2Cl2 mogu imati dvije prostorne strukture.
THE optički izomerizam nastaje kada, pri odbijanju polarizirane svjetlosti emitirane na strukturi, spojevi uspiju odbiti snop svijetleći lijevo, ako je lijevorotirajući (l) izomer, ili desno, kada je desnorotirajući izomer (d).
Primjer: Ova vrsta izomerizma javlja se kod mliječne kiseline. U nastavku imajte na umu da se spektralne slike izomera ne preklapaju, pa se stoga nazivaju enantiomeri.
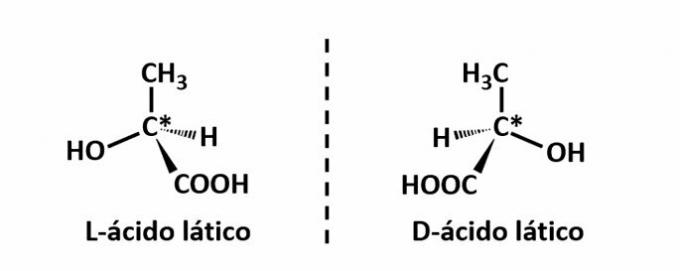
Simbol C* označava prisutnost kiralnog ugljika u ovoj strukturi, tj. atoma ugljika s 4 različita linkera.
Saznajte više o izomerizmu sa sadržajem:
- Vrste izomerizma
- prostorni izomer
- geometrijski izomer
- optički izomer
- Vježbe o izomeriji ravnine


