Valentni sloj posljednji je sloj elektroničke distribucije atoma. Kako je to najudaljeniji sloj, ujedno je i najudaljeniji od atomske jezgre.
Prema Pravilo okteta, valentnoj ljusci treba osam elektrona da se stabilizira.
Dakle, atomi dobivaju stabilnost kada u valentnoj ljusci imaju 8 elektrona. To se događa s plemenitim plinovima, koji imaju kompletan valentni sloj. Jedina iznimka je element Helij koji ima 2 elektrona.
Ostali elementi trebaju stvoriti kemijske veze kako bi primili nestale elektrone i došli do osam elektrona u valentnoj ljusci.
Elektroni valentne ljuske sudjeluju u vezama, jer su najizvanjskiji.
Slojevi elektrosfere
Prema Rutherford-Bohrovom atomskom modelu, elektroni se okreću oko atomske jezgre, u različitim energetskim slojevima.
Postoji sedam slojeva označenih slovima K, L, M, N, O, P i Q. Svaki podržava maksimalan broj elektrona.
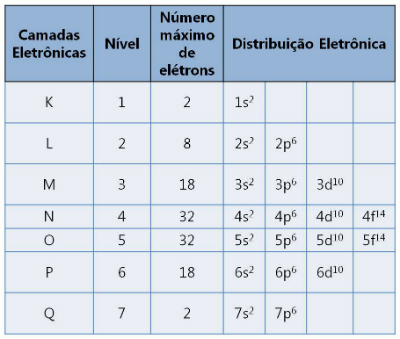 Elektronički slojevi i brojevi elektrona koje podržavaju
Elektronički slojevi i brojevi elektrona koje podržavaju
Pročitajte i vi:
- Bohrov atomski model
- Rutherfordov atomski model
- Plemeniti plinovi
- Pravilo okteta
Kako odrediti sloj Valencije?
Valentni sloj može se odrediti na dva načina: Eletronic distribucija i Periodni sustav elemenata.
Za određivanje valentnog sloja elektroničkom distribucijom, Dijagram Linusa Paulinga.
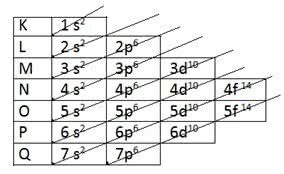 Paulingov dijagram
Paulingov dijagram
Podsjetimo da Paulingov dijagram slijedi rastući redoslijed energije. Posljednji sloj dobiven u elektroničkoj distribuciji je valentni sloj.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Dakle, u valentnom sloju, najenergičniji podrazina je posljednji sloj.
Primjeri:
Dušik - N
Atomski broj: 7
Elektronička distribucija: 1s2 2s2 2p3
Sloj Valencije: 2 s2 2p3, N ima 5 elektrona u valentnoj ljusci.
Željezo - Fe
Atomski broj: 26
Elektronička distribucija: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Sloj Valencije: 4 s2, Fe ima 2 elektrona u valentnoj ljusci.
Klor - Kl
Atomski broj: 17
Elektronička distribucija: 1s2 2s2 2p6 3s2 3p5
Sloj Valencije: 3 s2 3p5, Cl ima 7 elektrona u valentnoj ljusci.
Kisik - O
Atomski broj: 8
Elektronička distribucija: 1s2 2s2 2p4
Sloj Valencije: 2 s2 2p4, kisik ima 6 elektrona u valentnoj ljusci.
Ugljik - C
Atomski broj: 6
Elektronička distribucija: 1s2 2s2 2p2
Sloj Valencije: 2 s2 2p2, ugljik ima 4 elektrona u valentnoj ljusci.
Također pročitajte o Kvantni brojevi.
Do sada su korišteni primjeri s elementima u osnovnom stanju. Ali isti se princip može koristiti za ioni, kationi i anioni. Pogledajte primjer:
Kloridni anion - Cl-
Atomski broj klora je 17. Da je u osnovnom stanju, broj elektrona bio bi jednak broju protona. Međutim, u ovom slučaju postoji dobitak od 1 elektrona.
Prvo izvršite elektroničku distribuciju elementa Klor:
1s2 2s2 2p6 3s2 3p5
S pojačanjem dodatnog elektrona, dodajte u posljednji sloj:
1s2 2s2 2p6 3s2 3p6. Dakle, u valentnoj ljusci ima 8 elektrona (3s2 3p6).
Pogledajte i: Vježbe o elektroničkoj distribuciji.
Da bi se odredio valentni sloj kroz periodni sustav, potrebno je identificirati razdoblje i obitelj elemenata.
Dakle, dok obitelj 1A ima 1 valentni elektron, 2A ima 2 itd. Kemijski elementi sadržani u njemu obitelj periodnog sustava imaju jednak broj elektrona u valentnoj ljusci.
Međutim, ovo vrijedi samo za skupine 1, 2, 13, 14, 15, 16 i 17 koje imaju sljedeći broj elektrona u valentnoj ljusci 1, 2, 3, 4, 5, 6 i 7.
Za elemente u kojima taj odnos nije moguć, treba koristiti elektroničku distribuciju.
Ne zaboravi! Na kemijske veze proizlaze iz potrebe da se atomi stabiliziraju i tako tvore molekule. To se postiže davanjem elektrona iz valentne ljuske koji, budući da su dalje od jezgre, imaju tendenciju doniranja.
Također pročitajte o Molekularna geometrija.
Vježbe
1. Pronađite valentni sloj sljedećih elemenata:
Brom
35br
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Bromova valentna ljuska (obitelj 7A) ima 7 elektrona. To je zato što 4s2 i 4p5 pripadaju sloju N, dok 3d10 pripada sloju M.
Aluminij
13Al
1s2 2s2 2p6 3s2 3p1
Aluminijska valentna ljuska (obitelj 3A) ima 3 elektrona.
2. (UFSC) Broj elektrona u svakom podrazinu atoma stroncija (38Sr) u rastućem redoslijedu energije je:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP / 2013) Broj elektrona u valentnoj ovojnici atoma kalcija (Z = 20), u osnovnom stanju, je
do 1
b) 2
c) 6
d) 8
e) 10
b) 2
Pitanja za prijamni ispit provjerite s komentiranom rezolucijom u: Vježbe na periodnom sustavu.