Kp je akronim koji se koristi za određivanje konstanta ravnoteže u smislu parcijalnih pritisaka. Ova konstanta radi s vrijednostima plinovitih sudionika ravnoteže u atm jedinici, na primjer.

Jednadžba koja predstavlja kemijsku reakciju s plinovitim komponentama
U ovoj jednadžbi svi su sudionici plinoviti, pa kada sudjelujući plin ima a parcijalni tlak u smjesi, predstavljena je skraćenicom pX.
Prilikom postavljanja jednadžbe kemijske ravnoteže (u smislu koncentracije), produkti se moraju staviti u brojnik, a reaktanti se stavljaju u nazivnik:
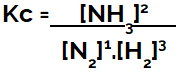
Kc izraz ravnoteže stvaranja amonijaka
izraz od konstanta ravnoteže u smislu tlaka (Kp) slijedi obrazac Kc, to jest, parcijalni tlakovi reagensa pozicionirani su u nazivnik, a parcijalni tlakovi proizvoda u brojniku:
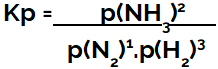
Kp ekspresija ravnoteže stvaranja amonijaka
opažanje: Ako je jednadžba reakcije kemijska ravnoteža ne predstavlja plinovitog sudionika, neće se automatski predstaviti Kp.
Primjer: (PUC-MG) Za reakciju: 2 CO(g) + O2 (g)? 2 CO2 (g), parcijalni pritisci CO
(g) to je2 (g) u ravnoteži su 0,2 atm, odnosno 0,4 atm. Ukupni tlak u sustavu je 1,4 atm. Vrijednost Kp jer je reakcija:a) 56.2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
Podaci dobiveni vježbom su:
Parcijalni tlak ugljičnog monoksida (pCO) = 0,2 atm;
Parcijalni tlak ugljičnog monoksida (pO2) = 0,4 atm;
Ukupni tlak =1,4 atm;
Da bismo odredili Kp ovog sustava, moramo izvršiti sljedeće korake:
1. korak: Odredite parcijalni tlak ugljičnog monoksida (pCO2).
Za to, samo zapamtite da je ukupni tlak (pt) zbroj svih parcijalnih tlakova:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. korak: Odredite Kp vježbe.
Za to samo upotrijebite vrijednosti u izrazu konstante ravnoteže Kp:
Kp = (pCO2)2
(pCO)2.(prah2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Od mene Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm