Neutralizirajuća reakcija nastaje kada kiselina reagira s bazom dajući vodu i sol. Kiselina daje H ione+ a baza osigurava ione OH- za stvaranje vode (H2O):
1 sat+(ovdje) + 1 OH-(ovdje) → H2O(ℓ)
Ova vrsta reakcije naziva se "neutralizacija", jer se pH medija neutralizira; pH vode je 7,0 (neutralno).
Da bi se te reakcije pojavile, potrebno je osloboditi određenu količinu topline, kao samo dio energije ioni se koriste za stvaranje veza koje rezultiraju molekulama vode, dok se ostatak energije oslobađa u dosta. Ova oslobođena energija se naziva Neutralizacijska entalpija (∆Hneutralizacija).

Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Budući da oslobađa toplinu, to odgovara egzotermnim reakcijama, u kojima će entalpija (globalna energija sustava) uvijek biti negativna, manja od nule.
U slučaju reakcije između jakih kiselina i jakih baza, vrijednost neutralizirajuće entalpije uvijek će biti jednaka - 13,8 kcal / mol ili - 57,7 kJ / mol. To se događa zato što su baze i jake kiseline potpuno disocirane u otopini i, prema tome, jedine Reakcija odgovorna za ispoljavanje topline bit će stvaranje vode, kao što je prikazano u tri primjera u nastavku:
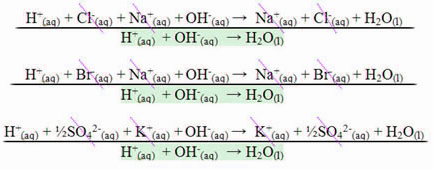
U slučaju reakcija neutralizacije koje uključuju slabe kiseline ili baze, vrijednost neutralizirajuće entalpije bit će manja od –57,7 kJ / mol.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Entalpija neutralizacije"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm. Pristupljeno 28. lipnja 2021.