Toplinska ravnoteža, koja se naziva i termodinamička ravnoteža, je kada dva tijela ili tvari dođu u ista temperatura.
Ovaj koncept termodinamike povezan je sa spontanim prijenosom topline (toplinska energija) koji se događa između dvaju tijela u dodiru.
U tom procesu toplije tijelo prenosi toplinu na hladnije tijelo dok oba ne budu na istoj temperaturi.

shema prijenosa topline
Izmjena energije između dva tijela (toplinska energija) rezultira gubitkom toplinske energije iz toplijeg tijela i dobitkom energije iz hladnijeg tijela.
Primjer
Kao primjer možemo spomenuti mješavinu vruće kave s hladnim mlijekom. Iako imaju različite početne temperature, u najkraćem vremenu najtoplije tijelo (kava) prenosi toplinsku energiju na ono najhladnije (mlijeko). Dakle, smjesa postaje mlaka kao rezultat toplinske ravnoteže.
Pod pretpostavkom da je kava bila na 50 ° C, a mlijeko na 20 ° C, toplinska ravnoteža se postiže kad su obje na 35 ° C.

širenje topline
Važno je napomenuti da je toplina razmjena energije i njezin se prijenos može dogoditi na tri načina:
- toplinska vodljivost: porast kinetičke energije;
- toplinska konvekcija: stvaranje konvekcijskih struja;
- toplinsko zračenje: pomoću elektromagnetskih valova.
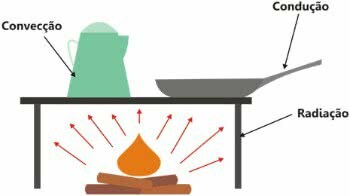
Vrste širenja topline
Čitaj više: širenje topline.
Formula
Za izračunavanje toplinske bilance koristi se sljedeća formula:
Q1 + Q2 + Q3... = 0 ili ΣQ = 0
Biće,
Q: količina topline (tjelesna temperatura)
Dakle, znamo da je zbroj svih toplinskih energija nula.
O osjetna toplina to je povezano s temperaturnim promjenama tijela. Izračunava se prema sljedećoj formuli:
Q = m. ç. Δθ
Gdje,
Q: količina osjetljive topline (vapno ili J)
m: tjelesna masa (g ili kg)
ç: specifična toplina tvari (kal / g ° C ili J / Kg ° C)
Δθ: varijacija temperature (° C ili K)
Također pročitajte oKalorimetrijaiToplina i temperatura.
Vježbe prijamnog ispita s povratnim informacijama
1. (Mackenzie) Kad pomiješamo 1,0 kg vode (osjetljiva specifična toplina = 1,0 cal / g ° C) na 70 ° C s 2,0 kg vode na 10 ° C, dobit ćemo 3,0 kg vode na:
a) 10 ° C
b) 20 ° C
c) 30 ° C
d) 40 ° C
e) 50 ° C
Alternativa c) 30 ° C
2. (UFP-RS) Razmotrite sljedeće izjave:
Ja Kada su dva tijela u toplinskoj ravnoteži, oba imaju jednaku količinu topline.
II. Kada su dva tijela u toplinskoj ravnoteži, oba imaju istu temperaturu.
III. Toplina je prijenos temperature s jednog tijela na drugo.
IV. Toplina je oblik energije u tranzitu.
Iz gornjih izjava može se reći da:
a) I, II, III i IV su točni
b) I, II, III su točni
c) I, II i IV su točni
d) II i IV su točni
e) II i III su točni
Alternativa d) II i IV su točne
3. (FATEC-SP) Sustav A je u toplinskoj ravnoteži s drugim B, a ovaj nije u toplinskoj ravnoteži s drugim C. Dakle, možemo reći da:
a) sustavi A i C imaju jednaku količinu topline.
b) temperatura A se razlikuje od temperature B.
c) sustavi A i B imaju istu temperaturu.
d) temperatura B se razlikuje od temperature C, ali C može imati istu temperaturu kao u sustavu A.
e) ništa od navedenog.
Alternativa c) sustavi A i B imaju istu temperaturu.
4. (UFV-MG) Kada su dva tijela različitih materijala u toplinskoj ravnoteži, izolirana od okoline, može se reći da:
a) najtopliji je onaj s najmanjom masom.
b) unatoč kontaktu, njihove temperature ne variraju.
c) najtopliji pruža toplinu najhladnijima.
d) najhladniji pruža toplinu najtoplijima
e) njihove temperature ovise o gustoći.
Alternativa b) unatoč kontaktu, njihove temperature ne variraju.
5. (UFScar-SP) Dva tijela A i B, s masama mTHE uB, u početku su na temperaturama tTHE i tiB, odnosno s tTHE tB. U određenom trenutku dovode se u toplinski kontakt. Nakon postizanja toplinske ravnoteže imat ćemo:
a) t’a> t’b
b) t’a c) t’a = t’b
d) n.d.a.
Alternativa c) t’a = t’b
Vidi također definicijuRavnoteža u fizici.



