Otopljena tvar i otapalo dvije su komponente homogene smjese koja se naziva kemijska otopina.
- Otopljeni: je tvar koja je raspršena u otapalu. Odgovara tvari koja će se otopiti i općenito se u manjoj količini predstavlja u otopini.
- Otapalo: je tvar u kojoj će se otopljena otopljena tvar stvoriti novi proizvod. U otopini se predstavlja u većoj količini.
Otapanje između otopljene tvari (dispergirane) i otapala (disperzanta) događa se interakcijama između njihovih molekula.
Razlika između ove dvije komponente otopine je u tome što je otopljena tvar tvar koja će se otopiti, a otapalo tvar koja će utjecati na otapanje.
Najpoznatije otapalo je voda, koja se smatra univerzalno otapalo. To je zato što ima sposobnost otapanja velike količine tvari.
Primjeri otapala i otapala
Pogledajte nekoliko primjera kemijskih otopina i otkrijte otopljene tvari i otapala svakog od njih:
Voda i sol
- Otopljena tvar: kuhinjska sol - natrijev klorid (NaCl)
- Otapalo: Voda
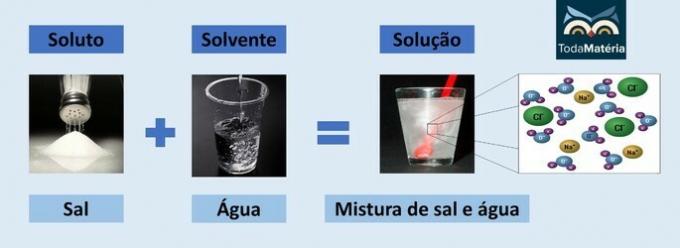
Kako je riječ o ionskom spoju, natrijev klorid u otopini disocira i stvara ione koji su zauzvrat solvatirani molekulama Voda.
Pozitivni pol vode (H+) stupa u interakciju s anionom soli (Cl-) i negativni pol vode (O2-) stupa u interakciju s kationom (Na+).
Ovo je vrsta elektrolitske otopine, jer su ionske vrste u otopini sposobne provoditi električnu struju.
vode i šećera
- Otopljena tvar: šećer - saharoza (C12H22O11)
- Otapalo: Voda

Šećer je kovalentni spoj i kada se otopi u vodi molekule razilaze se, ali ne mijenjaju identitet.
Ova vodena otopina klasificira se kao neelektrolitička, jer je otopljena tvar raspršena u otopini neutralna i, prema tome, ne reagira s vodom.
Ocat
- Otopljena tvar: octena kiselina (CH3COOH)
- Otapalo: Voda

Ocat je otopina koja sadrži najmanje 4% octene kiseline, a karboksilna kiselina koja, budući da je polarna, komunicira s vodom, također polarnom, putem vodikovih veza.
Važno pravilo topljivosti je da se poput otapa slično. Polarni spojevi otapaju se u polarnim otapalima, dok se nepolarne tvari otapaju u nepolarnim otapalima.
Ostala rješenja
Uz tekuće otopine postoje i plinovite i krute otopine.
Zrak koji udišemo primjer je plinovite otopine čiji su plinovi u većoj količini dušik (78%) i kisik (21%).
Na metalne legure čvrsta su rješenja. Na primjer, mjed (cink i bakar) smjesa je koja se koristi za izradu glazbenih instrumenata.
Želite li steći više znanja? Pa pročitajte ove ostale tekstove:
- Kemijska rješenja
- intermolekularne sile
- Homogene i heterogene smjese
Što je koeficijent topljivosti?
Koeficijent topljivosti je granica otopljene tvari dodane otapalu na određenoj temperaturi da nastane zasićena otopina.
O koeficijent topljivosti varira ovisno o uvjetima, a može se povećati ili smanjiti ovisno o promjenama temperature i otopljene tvari.
Postoji ograničenje do kojeg otapalo može provesti otapanje.
Primjer: Ako šećer stavite u čašu vode, u prvom ćete trenutku primijetiti da šećer nestaje u vodi.
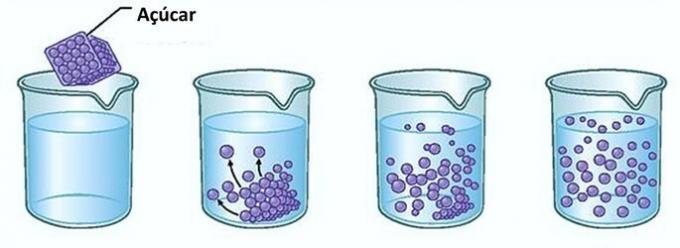
Međutim, ako nastavite dodavati šećer, otkrit ćete da će se on u nekom trenutku početi nakupljati na dnu čaše.
To je zato što je voda, koja je otapalo, dosegla svoju granicu topljivost i maksimalna količina koncentracije. Otopljena tvar koja ostane na dnu posude i ne otopi se zove pozadinsko tijelo.
Višak šećera na dnu čaše neće se otopiti i neće utjecati na koncentraciju otopine. Nadalje, šećer odložen na dnu čaše neće učiniti vodu slađom.
Klasifikacija rješenja
Otopine se mogu klasificirati prema količini otopljene otopljene tvari. Dakle, mogu biti tri vrste: zasićene, nezasićene i prezasićene.
- zasićena otopina: Otopina je dosegla granicu koeficijenta topljivosti, odnosno postoji najveća količina otopljene tvari u otapalu na određenoj temperaturi.
- nezasićena otopina: Količina otopljene otopljene tvari još nije dosegla koeficijent topljivosti. To znači da se može dodati više otopljene tvari.
- prezasićena otopina: Postoji više otopljene otopljene tvari nego u normalnim uvjetima. U ovom slučaju predstavljaju talog.
Da biste saznali više o rješenjima, pročitajte sljedeće tekstove.:
- Razrjeđivanje otopina
- Molalnost
- Molarnost
- Titracija
Koncentracija otopina
Iz otopljene tvari i otapala moguće je izračunati koncentraciju otopine.
Uobičajena koncentracija definira se kao omjer mase otopljene otopljene tvari u danom volumenu otopine.
Izračun koncentracije vrši se prema sljedećoj formuli:
Biće,
Ç: Koncentracija (g / L);
m: masa otopljene tvari (g);
V: volumen otopine (L).
Primjer:
(Faap) Izračunajte koncentraciju, u g / L, vodene otopine natrijevog nitrata koja sadrži 30 g soli u 400 ml otopine:
Razlučivost:
Obratite pažnju na podatke o količinama otopljene tvari i otapala. U 400 ml vodene otopine (otapala) nalazi se 30 g soli (otopljene tvari).
Međutim, volumen je u ml i moramo ga transformirati u L:
Da biste znali koncentraciju, morate primijeniti formulu:
Ovim rezultatom došli smo do zaključka da ćemo, kada pomiješamo 30 g soli s 400 ml vode, dobiti otopinu s koncentracijom od 75 g / L.
Za više informacija o tome kako izračunati zajedničku koncentraciju, ovi će tekstovi biti korisni.:
- Koncentracija otopine
- Vježbe o zajedničkoj koncentraciji


