Na intermolekularne sile su tema iz kemije koja se, zasigurno, može pojaviti na državnom ispitu za srednju školu (I ili). Stoga vrijedi pogledati glavni sadržaj ove teme u ovom članku.
Definicija
intermolekularne sile to su sile - različitog intenziteta (slabe, srednje ili jake) - elektrostatičke privlačnosti ili veze uspostavljene između molekula tvari koje održavaju međusobnu povezanost.
Vrste intermolekularnih sila
The) Inducirani dipol
I intermolekularna sila koji se javlja između molekula tvari s nepolarnim karakteristikama. To se događa, na primjer, između molekula tvari kao što je O2, H2, ne2, CO2, CH4.
Unija između ovih molekula nastaje kada se između njih stvori dipol. To se događa kada elektroni jedne molekule istisnu elektrone druge, stvarajući tako negativni i pozitivni pol koji se prenosi s jedne molekule na drugu.
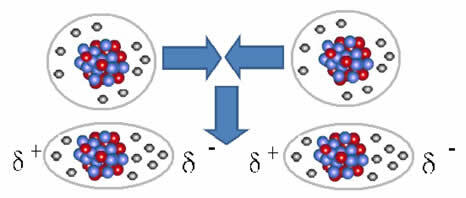
Prikaz stvaranja dipola u nepolarnim molekulama
Između ovih molekula stvorila su se dva pola, a negativni pol jednog stupa u interakciju s pozitivnim polovom drugog. Budući da su ti polovi stvoreni, riječ je o intermolekularnoj sili niskog intenziteta.
B) trajni dipol
I intermolekularna sila koji se javlja između molekula tvari s polarnom karakteristikom. Primjeri su molekule tvari kao što su HCN, H2O, NH3, CO, CH3Kl.
Unija između ovih molekula događa se kada negativni pol jedne u interakciji s pozitivnim polovom druge.
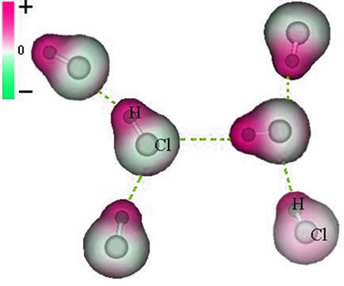
Prikaz trajne dipolne sile između molekula HCl
Kako polovi već postoje, trajna dipolna intermolekularna sila većeg je intenziteta od induciranog dipola.
ç) vodikove veze
Da intermolekularna sila javlja se između polarnih molekula koje imaju atom vodika vezan izravno za atom kisika, dušika ili fluora.
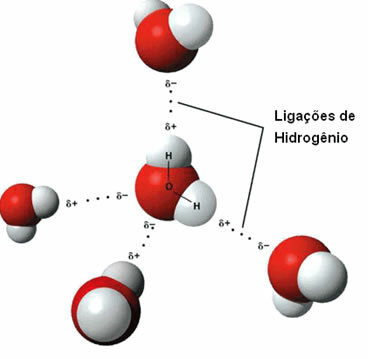
Prikaz vodikovih veza između molekula vode
Vodikova veza nastaje kada vodik u jednoj molekuli stupi u interakciju s kisikom, dušikom ili fluorom druge molekule.
d) dipolni ion
Ova intermolekularna sila javlja se između polarne molekule koja ima par nevezujućih elektrona i iona (kation ili anion) u otopini.
Na primjer, molekula vode ima dva para nevezujućih elektrona u kisiku. Ako u vodenom mediju ima iona, oni se približavaju molekuli vode, jer u njoj postoje polovi.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Važnost
Važnost poznavanja intermolekularne sile za Enem to je razumijevanje koje oni donose u vezi s fizikalnim stanjima, točkom topljenja, vrelištem i topljivošću tvari.
The) Odnos s talištem i vrelištem tvari
Talište označava temperaturu prijelaza iz čvrstog u tekuće stanje, a vrelište temperaturu prijelaza iz tekućeg u plinovito stanje.
Ovaj je odlomak izravno povezan s interakcijom između molekula tvari, jer ono što razlikuje jedno fizičko stanje od drugog jest razina agregacije između njegovih molekula.
Dakle, što je intermolekularna sila intenzivnija, točke topljenja i ključanja su veće. Što su intermolekularne sile manje intenzivne, točke topljenja i vrenja su niže. Dakle, možemo definirati silazni redoslijed tališta i vrelišta:
Vodikova veza> trajni dipol> inducirani dipol
B) Odnos prema topljivosti
Općenito, moramo znati da se slično otapa slično, odnosno polarna tvar otapa polarnu tvar, a nepolarna tvar otapa nepolarnu tvar.
Međutim, još uvijek postoji mogućnost interakcije između molekula otopljene tvari i molekula otapala. To se događa samo ako je ta nova interakcija veća od onoga što već postoji između molekula same tvari.
Primjer primjene intermolekularne sile u Enemu
1. primjer: (Enem-2011) Ljudska koža, kad je dobro hidratizirana, poprima dobru elastičnost i mekan i gladak izgled. S druge strane, kad je suho, gubi elastičnost i djeluje neprozirno i hrapavo. Da biste spriječili isušivanje kože, potrebno je, kad god je to moguće, koristiti hidratantne hidratantne kreme, uglavnom izrađene od glicerina i polietilen glikola:

Zadržavanje vode na površini kože koju promiču hidratantne kreme posljedica je interakcije hidroksilnih skupina sredstava za vlaženje s vlagom u okolišu putem:
a) ionske veze
b) Londonske snage
c) kovalentne veze
d) dipol-dipolne sile
e) vodikove veze
Odgovor na ovo pitanje je vodikova veza, jer molekula vode ima vodik vezan za atom kisika. Isto se događa s molekulama propilen glikola i polietilen glikola, što je povoljan uvjet za pojavu ove vrste intermolekularne sile.
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Intermolekularne sile u neprijatelju"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Pristupljeno 27. lipnja 2021.


