Točka topljenja i vrelište predstavljaju temperaturu na kojoj tvar mijenja stanje pod određenim tlakom.
U slučaju tališta, tvar prelazi iz čvrstog u tekuće stanje. Tačka ključanja odnosi se na promjenu iz tekućeg u plinovito stanje.
Na primjer, led se počinje pretvarati u vodu u tekućem obliku kada je njegova temperatura jednaka 0 ° C. Dakle, točka topljenja vode je 0 ° C (pod pritiskom od 1 atmosfere).
Da bi iz tekuće prešla u parnu, voda mora doseći temperaturu od 100 ° C. Dakle, vrelište vode je 100 ° C (pod pritiskom od 1 atmosfere).

Tačka fuzije
Kad tvar u čvrstom stanju primi toplina, dolazi do povećanja stupnja agitacije njegovih molekula. Posljedično se i njegova temperatura povećava.
Po postizanju određene temperature (tališta), miješanje molekula je takvo da prekida unutarnje veze između atoma i molekula.
U ovom trenutku tvar počinje mijenjati svoje stanje i prijeći će u tekuće ako nastavi primati toplinu.
Tijekom Fuzija njegova temperatura ostaje konstantna, jer se primljena toplina koristi isključivo za promjenu stanja.

Zove se toplina po jedinici mase potrebna za promjenu faza latentna toplina fuzije (Lf) i karakteristika je tvari.
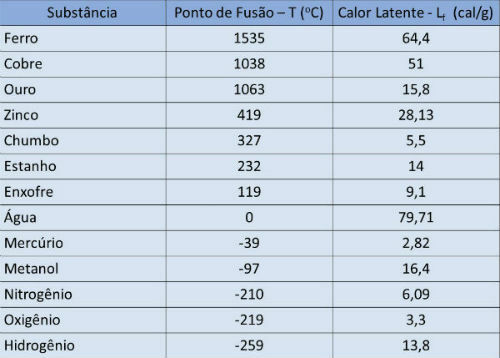
Talište i tablica latentne topline
U donjoj tablici naznačujemo temperaturu tališta i latentnu toplinu nekih tvari do atmosferski pritisak.
Vrelište
THE ključanje karakterizira ga brzi prelazak iz tekućine u plinovito stanje, uz stvaranje para (mjehurića) unutar tekućine.
Kao i kod fuzije, postoji temperatura (točka vrenja) pri kojoj se dalja tvar mijenja iz tekućeg u plinovito stanje.
Da bi se to dogodilo, tvar mora primati toplinu. Tijekom cijele promjene faze temperatura ostaje konstantna.
latentna toplina isparavanje (Lv) je količina topline po jedinici mase potrebna da bi tvar promijenila fazu.
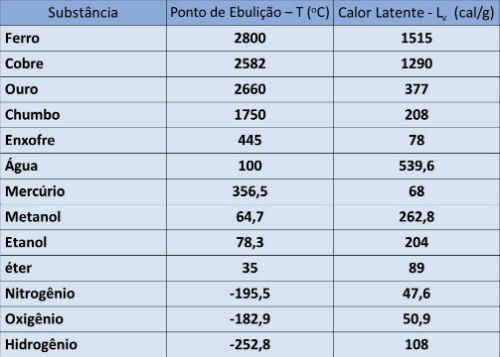
Tačka ključanja i tablica latentne topline
U donjoj tablici naznačujemo temperaturu vrelišta i latentnu toplinu isparavanja nekih tvari pri atmosferskom tlaku.
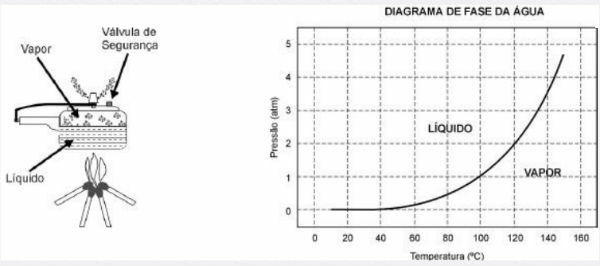
Smetnje pod pritiskom
Temperatura tališta i vrelišta ovisi o pritisku koji se vrši na tvar.
Općenito, tvari se povećavaju u volumenu kad se podvrgnu fuziji. Ta činjenica znači da što je veći tlak, to je veća temperatura da tvar promijeni svoju fazu.
Iznimka se javlja kod nekih tvari, uključujući vodu, koja smanjuje svoj volumen topljenjem. U tom će slučaju veći tlak sniziti točku topljenja.

Smanjenje tlaka dovodi do nižeg vrelišta određene tvari, što znači da će tvar ključati na nižoj temperaturi.
Primjerice, na mjestima iznad razine mora voda kipi na temperaturama ispod 100 ° C. Kao rezultat, potrebno je puno duže kuhati na tim mjestima nego na mjestima na razini mora.
Pročitajte i vi:
- Promjene fizikalnog stanja
- Termometrijske vage
- Termometrijske vage - vježbe
- Fizička stanja vode
- Dijagram faza
- Očvršćivanje
- Kondenzacija
- Koligativna svojstva
- Periodična svojstva
- Isparavanje
- Vježbe na periodnom sustavu