yttrium, प्रतीक Y और परमाणु संख्या 39, एक चांदी के रंग की धातु है जो आवर्त सारणी के समूह 3 में स्थित है, जो के ठीक नीचे है स्कैंडियम, प्रतीक एस.सी. हालांकि, रासायनिक रूप से, येट्रियम लैंथेनम और अन्य लैंथेनाइड्स के समान है, जिसे दुर्लभ पृथ्वी धातुओं के समूह का सदस्य माना जाता है।
इस धातु का व्यापक रूप से पुराने टेलीविजन स्क्रीन और अधिक आधुनिक एलसीडी मॉडल के निर्माण में उपयोग किया गया था, क्योंकि यह तत्व प्राथमिक रंगों के निर्माण में मदद करता है। इसमें प्रासंगिक औद्योगिक अनुप्रयोग भी हैं, जैसे उत्प्रेरक, लेजर, सिरेमिक और सुपरकंडक्टर्स के निर्माण में, जो बिना सामग्री के हैं विद्युतीय प्रतिरोध.
यह भी देखें: सोना - उत्कृष्ट विद्युत चालन क्षमता वाला रासायनिक तत्व
यट्रियम के बारे में सारांश
- Yttrium एक चांदी की धातु है जो के समूह 3 में स्थित है आवर्त सारणी
- f ब्लॉक में न होने के बावजूद, yttrium को एक दुर्लभ पृथ्वी धातु माना जाता है।
- इसके मुख्य खनिज स्रोत हैं:
- मोनाजाइट;
- बास्टनासाइट;
- ज़ेनोथिमिया;
- गैडोलिनाइट।
- यह अपने ल्यूमिनसेंट गुणों के कारण इलेक्ट्रॉनिक्स के क्षेत्र में व्यापक रूप से उपयोग किया जाता है।
- इसका उपयोग लेजर के निर्माण में भी किया जाता है।
- Yttrium यौगिकों को सुपरकंडक्टर्स के रूप में इस्तेमाल किया जा सकता है, जिसने चुंबकीय उत्तोलन तकनीक की उन्नति की अनुमति दी।
- Yttrium की खोज स्वीडिश गांव Ytterby में की गई थी, जहां कई की खोज की गई थी धातुओं आवर्त सारणी की दुर्लभ पृथ्वी।
यत्रियम गुण
- प्रतीक: वाई
- परमाणु संख्या: 39.
- परमाणु भार: 88,906 घन मीटर
- विद्युत ऋणात्मकता: 1,2.
- संलयन बिंदु: 1530 डिग्री सेल्सियस।
- क्वथनांक: 3264 डिग्री सेल्सियस।
- घनत्व: 4.5 ग्राम सेमी-3 (20 डिग्री सेल्सियस पर)।
- इलेक्ट्रोनिक विन्यास: [क्र] 5एस2 4डी1.
- रासायनिक श्रृंखला: समूह 3; संक्रमण धातुओं; दुर्लभ पृथ्वी धातु।
यट्रियम की विशेषताएं
येट्रियम सिल्वर रंग की और चमकदार धातु है। हवा के संपर्क में स्थिर माना जाता है, की एक पतली परत के बाद से ऑक्साइड इसकी सतह पर बनता है, इसके नीचे धातु पदार्थ के हमले को रोकता है। हालाँकि, यह परत धातु की चमक को कम कर देती है।

प्रतिक्रियाशीलता के लिए, yttrium प्रतिक्रिया कर सकता है:
- साथ हैलोजन, कमरे के तापमान पर;
- ऑक्सीजन गैस के साथ और अधिकांश के साथ nonmetals, हीटिंग के तहत:
- 4 वाई + 3 ओ2 → 2 वाई23
- 2 वाई + 3 एक्स2 → 2 वाईएक्स3, X = F, Cl, Br और I. के साथ
इसके अलावा, yttrium भी ठंडे पानी के साथ धीरे-धीरे प्रतिक्रिया करता है और में घुल जाता है अम्ल पतला, गैस छोड़ना हाइड्रोजन.
लैंथेनम और अन्य लैंथेनाइड्स के समान होने के कारण, यट्रियम के लिए वर्णित और ज्ञात रसायन वह है जिसमें यह +3. के बराबर ऑक्सीकरण अवस्था है, जब यह तत्व अपने तीन संयोजकता इलेक्ट्रॉनों को खो देता है (4s2 और 5डी1).
यह भी पढ़ें: बेरियम - क्षारीय पृथ्वी धातु अपनी विषाक्तता के लिए जानी जाती है
यत्रियम कहाँ पाया जाता है?
यत्रियम कई खनिजों में हो सकता है अन्य दुर्लभ पृथ्वी धातुओं के साथ सहवर्ती रूप से। इन खनिजों में से एक मोनाजाइट है, एक फॉस्फेट जिसमें येट्रियम के अलावा, इनमें से कई तत्व शामिल हो सकते हैं, जैसे:
- सैरियम (सीई);
- लैंथेनम (ला);
- नियोडिमियम (एनडी);
- प्रेजोडायमियम (पीआर);
- थोरियम (थ).

अन्य संभावित येट्रियम खनिज हैं:
- बास्टनासाइट (एक दुर्लभ-पृथ्वी फ्लोरोकार्बन);
- xenothymia (एक yttrium orthophosphate, जिसे xenothym या xenothymium के रूप में भी जाना जाता है);
- गैडोलिनाइट (एक दुर्लभ-पृथ्वी सिलिकेट, जिसे येटरबाइट भी कहा जाता है)।

संरचना विविध है, लेकिन yttrium में समृद्ध एक अयस्क को के द्रव्यमान से लगभग 1% माना जाता है तत्त्व.
इसे कई प्रकार से प्राप्त किया जा सकता है। की क्लासिक पद्धति प्राप्त करने में एसिड या बेसिक लीचिंग (धोना) शामिल है, जो yttrium समाधान उत्पन्न करता है, का उपयोग कर:
- हाइड्रोक्लोरिक एसिड;
- सल्फ्यूरिक एसिड;
- सोडियम हाइड्रॉक्साइड.
हालांकि, लीचिंग इतना चयनात्मक नहीं है क्योंकि यह खनिज की सभी दुर्लभ मिट्टी के साथ एक समाधान बनाता है। इसलिए, द्वितीय विश्व युद्ध के बाद, आयन एक्सचेंज के माध्यम से अलगाव के लिए और अधिक परिष्कृत तकनीकें बनाई गईं, उदाहरण के लिए, जिसने चयनात्मकता की कमी प्रदान की, जिससे विभिन्न धातुओं को अलग करना संभव हो गया खनिज।
yttrium को उसके शुद्ध (धात्विक) रूप में प्राप्त करने के लिए, YF यौगिकों को कम किया जाना चाहिए3 या YCl3, जिसके साथ किया जाना चाहिए कैल्शियम या पोटैशियम, क्रमश।
यत्रियम अनुप्रयोग
इलेक्ट्रॉनिक्स के क्षेत्र में Yttrium का बहुत महत्व है। कई दुर्लभ-पृथ्वी की तरह, येट्रियम यौगिक जैसे कि Y23, ल्यूमिनसेंट गुण होते हैं (एक उत्तेजना पर प्रकाश उत्सर्जित करते हैं, जैसे कि a आयनित विकिरण), जिसे फॉस्फोरस भी कहा जाता है। येट्रियम फास्फोरस थे टेलीविजन ट्यूबों पर लागू प्राथमिक रंग हरा, नीला और लाल उत्पन्न करने के लिए रंग।
इन यौगिकों का उपयोग टेलीविजन के अलावा अन्य सामग्रियों में किया जा सकता है। के निर्माण में उनका उपयोग करना संभव है ऑप्टिकल फाइबर, फ्लोरोसेंट लैंप, एलईडी, पेंट, वार्निश, कंप्यूटर स्क्रीन आदि।
इसके ल्यूमिनसेंट गुणों के कारण, yttrium का उपयोग में भी किया जा सकता है लेज़रों का निर्माण, जैसा कि एनडी: वाईएजी लेजर के मामले में है, जिसका संक्षिप्त नाम येट्रियम गार्नेट (एक खनिज वर्ग) के लिए है और अल्युमीनियम, सूत्र Y. का3अली512, नियोडिमियम (एनडी) के साथ डोप किया गया।
यह याद रखने योग्य है कि लेजर एक प्रकार की विशेषता, मोनोक्रोमैटिक प्रकाश उत्सर्जन है, जो कि लंबाई के साथ है लहर विशिष्ट। एनडी: वाईएजी के मामले में, नियोडिमियम, एनडी आयन के रूप में होता है3+, प्रकाश के उत्सर्जन के लिए जिम्मेदार है लेज़र, जबकि YAG क्रिस्टल ठोस मैट्रिक्स होने के लिए जिम्मेदार हैं।
इस उच्च शक्ति वाले लेजर का उपयोग किया जा सकता है:
- चिकित्सा और दंत चिकित्सा की शल्य चिकित्सा प्रक्रियाओं में;
- डिजिटल संचार में;
- तापमान और दूरी को मापने में;
- औद्योगिक काटने की मशीनों में;
- माइक्रोवेल्ड में;
- फोटोकैमिस्ट्री के क्षेत्र में प्रयोगों में।

चिकित्सा में एक सामान्य अनुप्रयोग नेत्र विज्ञान के क्षेत्र में है, जहां लेजर का उपयोग रेटिना टुकड़ी के उपचार में और मायोपिया के सुधार के लिए किया जाता है। त्वचाविज्ञान में, इसका उपयोग त्वचा को एक्सफोलिएट करने के लिए किया जाता है।
यत्रियम भी है सुपरकंडक्टर्स में उपयोग किया जाता है. ऐसा इसलिए है क्योंकि 1987 में, अमेरिकी भौतिकविदों ने येट्रियम यौगिक, Y. के अतिचालक गुणों की खोज की थी1,2बी 0 ए0,8CuO4, जिसे आमतौर पर YBCO कहा जाता है। आप अतिचालक संचालन करने में सक्षम सामग्री हैं बिजली प्रतिरोध के बिना, बहुत कम तापमान पर, जिसे महत्वपूर्ण तापमान के रूप में जाना जाता है।

YBCO के मामले में, महत्वपूर्ण (सुपरकंडक्टिंग) तापमान 93 K (-180 °C) है, जो क्वथनांक के तापमान से ऊपर है। नाइट्रोजन तरल, जो 77 K (-196 °C) है। पिछले सुपरकंडक्टर्स, जैसे लैंथेनम (ला) के बाद से इसने इसके उपयोग को बहुत आसान बना दिया2CuO3), का 35 K (-238 °C) की सीमा में एक महत्वपूर्ण तापमान था, जिसे तरल हीलियम से ठंडा करने की आवश्यकता होती है, जो नाइट्रोजन की तुलना में अधिक महंगा होता है।
सुपरकंडक्टर्स चुंबकीय (या क्वांटम) उत्तोलन प्रभाव के केंद्र में होते हैं, जिसमें a चुंबकीय क्षेत्र (चुंबक) सुपरकंडक्टर के उत्तोलन की अनुमति देता है, जिसे मीस्नर प्रभाव द्वारा समझाया गया है। पटरियों पर तैरने वाली मैग्लेव ट्रेनों के उत्पादन के लिए ऐसी तकनीक की खोज की गई थी।
![शंघाई, चीन में मैग्लेव ट्रेन। [2]](/f/90f8d7b9365a1f52d4e51f5367f7fc62.jpg)
Yttrium में अन्य अनुप्रयोग भी हैं, जैसे प्रोडक्शन उत्प्रेरक और चीनी मिट्टी की चीज़ें. येट्रियम सिरेमिक का उपयोग अपघर्षक और अपवर्तक सामग्री (उच्च तापमान के लिए प्रतिरोधी) के उत्पादन के लिए किया जाता है:
- के सेंसर ऑक्सीजन कारों में;
- जेट इंजन की सुरक्षात्मक परतें;
- जंग और पहनने के प्रतिरोध के साथ उपकरणों को काटना।
अधिक जानिए:विद्युत चुंबकत्व - बिजली, चुंबकत्व और उनके संबंधों का अध्ययन
यट्रियम के साथ सावधानियां
विषैला या कार्सिनोजेनिक पदार्थ न होने के बावजूद, yttrium में साँस लेना, अंतर्ग्रहण करना या स्पर्श करना जलन और क्षति का कारण बन सकता है फेफड़ों को। पाउडर के रूप में, येट्रियम प्रज्वलित कर सकता है। सबसे बड़ी चिंता येट्रियम लेज़रों के संबंध में है, क्योंकि उनकी महान शक्ति आँखों के लिए हानिकारक हो सकती है।
यत्रियम का इतिहास
Yttrium नाम एक स्वीडिश गाँव Ytterby से निकला है, जिसमें एक खदान है जहाँ चार दुर्लभ पृथ्वी धातुओं की खोज की गई थी:
- यत्रियम;
- येटरबियम;
- एर्बियम;
- येटरबियम
इस गांव का वैज्ञानिक इतिहास 1789 में शुरू होता है, जब कार्ल एक्सेले अरहेनियस ने काली चट्टान के एक टुकड़े को देखा एक चट्टान के ऊपर। अरहेनियस स्वीडिश सेना में एक युवा लेफ्टिनेंट था और खनिजों के लिए उसकी बहुत प्रशंसा थी। प्रारंभ में माना जाता है टंगस्टन, फ़िनलैंड के तुर्कू में रॉयल अकादमी में रसायन विज्ञान के प्रोफेसर अरहेनियस के एक मित्र जोहान गैडोलिन को काली चट्टान भेजी गई थी।
गैडोलिन ने महसूस किया कि ब्लैक रॉक, मिनरल येटरबाइट (बाद में उनके सम्मान में गैडोलिनाइट का नाम बदलकर) से प्राप्त किया गया था। नए तत्वों का एक ऑक्साइड होता है दुर्लभ भूमि। स्वीडिश रसायनज्ञ एंडर्स गुस्ताफ एकेबर्ग ने गैडोलिन की खोज की पुष्टि की और इसे यत्रिया ऑक्साइड कहा।
इसके बाद पहली बार yttrium तत्व पृथक था, हालांकि अन्य तत्वों के साथ मिश्रित, 1828 में, फ्रेडरिक वोहलर द्वारा, जिन्होंने गैस पारित किया था क्लोरीन खनिज गैडोलिनाइट द्वारा और इस प्रकार yttrium क्लोराइड (YCl .) का गठन किया3) निर्जल, जिसे आगे पोटेशियम का उपयोग करके धात्विक यट्रियम में घटा दिया गया था।
अंत में, अरहेनियस द्वारा खोजी गई काली चट्टान में आठ दुर्लभ पृथ्वी धातुओं के ऑक्साइड पाए गए:
- एर्बियम;
- टेरबियम;
- येटरबियम;
- स्कैंडियम;
- थुलियम;
- होल्मियम;
- डिस्प्रोसियम;
- ल्यूटेटियम
यत्रियम पर हल किए गए अभ्यास
प्रश्न 1
(Unaerp-SP) 1911 में खोजी गई बिजली के अतिचालकता की घटना एक बार फिर वैज्ञानिक जगत के ध्यान का विषय थी। बेंडनोज़ और मुलर ने पाया कि सिरेमिक सामग्री इस प्रकार के व्यवहार को प्रदर्शित कर सकती है, जिससे इन दोनों को नोबेल पुरस्कार मिला। 1987 में भौतिक विज्ञानी सुपरकंडक्टिंग सिरेमिक के निर्माण में सबसे महत्वपूर्ण रासायनिक तत्वों में से एक येट्रियम है:
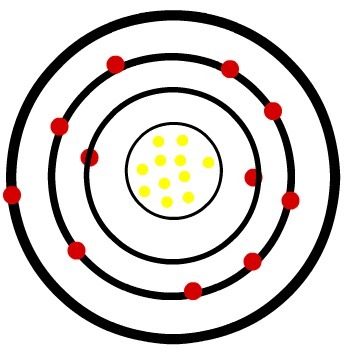
1s2 2एस2 2पी6 3एस2 3पी6 4एस2 3डी10 4पी6 5एस24डी1
yttrium के लिए कोशों की संख्या और सबसे ऊर्जावान इलेक्ट्रॉनों की संख्या क्रमशः होगी:
ए) 4 और 1
बी) 5 और 1
सी) 4 और 2
डी) 5 और 3
ई) 4 और 3
संकल्प:
वैकल्पिक बी
संयोजकता परत yttrium का पाँचवाँ कोश है, जिसमें 5s उपकोश में केवल 2 इलेक्ट्रॉन होते हैं2. इस प्रकार, यह निष्कर्ष निकाला जा सकता है कि yttrium में 5 परतें होती हैं। सबसे ऊर्जावान सबलेवल में रखा जाने वाला आखिरी है इलेक्ट्रॉनिक वितरण, क्योंकि यह ऊर्जा का बढ़ता वितरण है। इसलिए, सबसे ऊर्जावान सबलेवल 4d. है1, जिसमें केवल 1 इलेक्ट्रॉन है।
प्रश्न 2
येट्रियम ऑक्साइड, Y23, एक यौगिक है जिसका उपयोग सुपरकंडक्टिंग सिरेमिक के निर्माण के लिए किया जाता है, जैसे कि YBCO, जिसमें येट्रियम, बेरियम, तांबा और ऑक्सीजन होता है। सुपरकंडक्टर के निर्माण में, yttrium उसी ऑक्सीकरण संख्या को बनाए रखता है जो कि yttrium ऑक्साइड में होता है। यह ऑक्सीकरण संख्या इसके बराबर है:
ए) -3
बी) 0
सी) +3
डी) -2
ई) +2
संकल्प:
वैकल्पिक सी
जैसे ऑक्सीजन में ऑक्साइड होता है, ऑक्सीकरण संख्या (आयनिक बंधन का प्रदर्शन करते समय आयन जो चार्ज प्राप्त करता है) -2 के बराबर, yttrium की ऑक्सीकरण संख्या की गणना निम्नानुसार की जा सकती है:
2x + 3 (-2) = 0
जहाँ x परिकलित किए जाने वाले yttrium की ऑक्सीकरण संख्या है, वहाँ समीकरण शून्य पर सेट होना चाहिए, क्योंकि ऑक्साइड विद्युत रूप से तटस्थ है, न कि a आयन.
गणना सही ढंग से करना:
2x + -6 = 0
2x = 6
एक्स = 3
हमारे पास है कि x का मान +3 के बराबर है।
छवि क्रेडिट
[1] विचारो का आनंद / Shutterstock
[2] गिरगिट आँख / Shutterstock
स्टेफ़ानो अराउजो नोवाइस द्वारा
रसायन विज्ञान शिक्षक