कहा जाता है आयन बीम एक आयन का आकार। इस गुण का अध्ययन परमाणु त्रिज्या और आयनों के बारे में ज्ञान पर निर्भर है।
परमाणु का आधा घेरा: एक तटस्थ परमाणु के आकार का एक माप है (नाभिक से अंतिम इलेक्ट्रोस्फीयर तक सैद्धांतिक दूरी)।
आयनों: परमाणु जो खो देते हैं (धनायन) या इलेक्ट्रॉनों (आयनों) को प्राप्त करते हैं।
a. के नाभिक के अंदर प्रोटॉन परमाणु इलेक्ट्रोस्फेयर में मौजूद इलेक्ट्रॉनों (नकारात्मक कणों) पर एक आकर्षक बल लगाते हैं। प्रोटॉन की संख्या जितनी अधिक होगी, यह आकर्षण उतना ही अधिक होगा और इसके विपरीत। जब एक परमाणु में इलेक्ट्रॉनों की संख्या को इन कणों के नुकसान या लाभ से संशोधित किया जाता है, तो प्रोटॉन और इलेक्ट्रॉनों के बीच आकर्षण निम्नानुसार संशोधित होता है:
कटियन के मामले में:
इलेक्ट्रोस्फीयर में इलेक्ट्रॉनों की संख्या नाभिक के अंदर प्रोटॉन की संख्या से कम हो जाती है, जो नाभिक के आकर्षण बल को अधिक बनाता है, इलेक्ट्रॉनों को इसके करीब खींचता है। इलेक्ट्रोस्फीयर। परिणाम परमाणु की त्रिज्या में कमी है। इस प्रकार, किसी धनायन की त्रिज्या हमेशा उसके उदासीन परमाणु की त्रिज्या से छोटी होगी।
तटस्थ परमाणु त्रिज्या > धनायन त्रिज्या
आयनों के मामले में:
इलेक्ट्रोस्फीयर में इलेक्ट्रॉनों की संख्या नाभिक के अंदर प्रोटॉन की संख्या से अधिक हो जाती है। इस मामले में, नाभिक द्वारा लगाए गए आकर्षण बल को इलेक्ट्रोस्फीयर में मौजूद इलेक्ट्रॉनों के बीच प्रतिकर्षण बल द्वारा दूर किया जाता है।परिणामस्वरूप परमाणु की त्रिज्या में वृद्धि होती है। अत: किसी ऋणायन की त्रिज्या सदैव उसके उदासीन परमाणु की त्रिज्या से अधिक होगी।
ऋणायन त्रिज्या > उदासीन परमाणु त्रिज्या
नीचे प्रस्तुत दो स्थितियां इस बात का एक अच्छा उदाहरण हैं कि आयन की त्रिज्या का क्या होता है:
१) तटस्थ सोडियम परमाणु (11Na) और सोडियम धनायन (11पर+)
जबकि उदासीन सोडियम परमाणु में ग्यारह प्रोटॉन (पीले गोले) और ग्यारह इलेक्ट्रॉन (लाल गोले) होते हैं, सोडियम धनायन में ग्यारह प्रोटॉन और दस इलेक्ट्रॉन होते हैं।

सोडियम तटस्थ परमाणु मॉडल
जब उदासीन सोडियम परमाणु एक इलेक्ट्रॉन खो देता है, तो त्रिज्या घट जाती है।
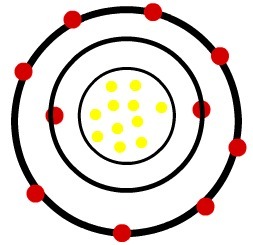
सोडियम धनायन का मॉडल
अवलोकन: धनायन की छवि में तीसरे स्तर का प्रतिनिधित्व नहीं किया गया था, क्योंकि चूंकि यह एकमात्र इलेक्ट्रॉन खो गया था, यह खाली हो गया था और इसलिए, अवहेलना की गई थी, लेकिन यह मौजूद है।
२) फास्फोरस उदासीन परमाणु (15पी) और फास्फोरस केशन (15पी-3)
जबकि तटस्थ फास्फोरस परमाणु में पंद्रह प्रोटॉन (पीले गोले) और पंद्रह इलेक्ट्रॉन (लाल गोले) होते हैं, फॉस्फोरस आयन में पंद्रह प्रोटॉन और अठारह इलेक्ट्रॉन होते हैं।
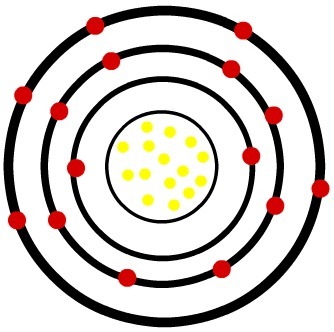
तटस्थ फॉस्फोर परमाणु का मॉडल
जब तटस्थ फास्फोरस परमाणु तीन इलेक्ट्रॉन प्राप्त करता है, तो त्रिज्या बढ़ जाती है।
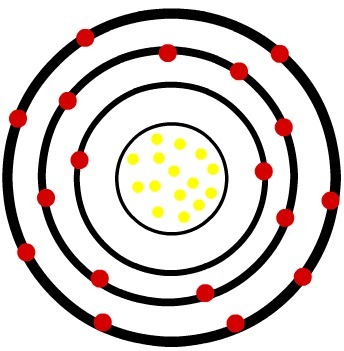
फॉस्फोर के आयन का मॉडल Model
मेरे द्वारा। डिओगो लोपेज डायस
