वैद्युतीयऋणात्मकता यह किसी अन्य रासायनिक तत्व से जुड़े होने पर एक परमाणु की इलेक्ट्रॉनों को अपनी ओर आकर्षित करने की प्रवृत्ति है। एक सहसंयोजक बंधन के माध्यम से, अर्थात्, जिसमें इलेक्ट्रॉनों का बंटवारा होता है, इस अणु को मानते हुए पृथक।
आइए प्रस्तुत अवधारणा को बेहतर ढंग से समझने के लिए दो उदाहरणों पर विचार करें:
पहला उदाहरण: हाइड्रोजन गैस अणु: एच2 → एच - एच
जब दो हाइड्रोजन परमाणु एक साथ आते हैं, तो प्रत्येक के नाभिक के बीच आकर्षण बल एक ही समय में उत्पन्न होते हैं। इनमें से एक परमाणु दूसरे परमाणु के इलेक्ट्रॉन द्वारा और इलेक्ट्रॉनों और दोनों के नाभिकों के बीच प्रतिकर्षण बल परमाणु। जब ये बल संतुलन तक पहुँच जाते हैं, तो दो इलेक्ट्रॉन इलेक्ट्रोस्फीयर के एक क्षेत्र में होते हैं जो दोनों के बीच कहीं होता है। अणु के परमाणु, जिसमें दोनों दो इलेक्ट्रॉनों के साथ परस्पर क्रिया करते हैं, स्थिर हो जाते हैं, अर्थात दो परमाणु एक जोड़ी साझा करते हैं इलेक्ट्रॉन।
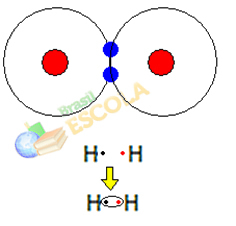
यह एक सहसंयोजक बंधन है, जो एक अणु बनाता है। लेकिन चूंकि इस अणु के दो परमाणु बिल्कुल समान हैं, इसलिए जिस तरह से वे एक दूसरे के लिए इलेक्ट्रॉनों को आकर्षित करते हैं वह भी वही है। तो हम कहते हैं कि
कोई वैद्युतीयऋणात्मकता अंतर नहीं है या वह यह ध्रुवीय है.दूसरा उदाहरण: हाइड्रोजन क्लोराइड अणु: HCℓ
इस मामले में, विभिन्न तत्वों के बीच एक इलेक्ट्रॉन जोड़ी का बंटवारा किया जाता है, क्योंकि इस संबंध में, क्लोरीन परमाणु हाइड्रोजन की तुलना में अधिक तीव्रता वाले इलेक्ट्रॉनों को आकर्षित करता है। इसलिए, हम कहते हैं कि क्लोरीन हाइड्रोजन की तुलना में अधिक विद्युत ऋणात्मक है।
जैसा कि नीचे दिए गए चित्र में दिखाया गया है, वैद्युतीयऋणात्मकता में अंतर के कारण, a विद्युत द्विध्रुव (μ), जो दो विद्युत मोनोपोल हैं, जिनमें इलेक्ट्रॉन क्लोरीन की ओर अधिक आकर्षित होते हैं। तो बांड एच H सीℓ का क्लोरीन ( partial negative) पर आंशिक नकारात्मक चार्ज होगा-) और हाइड्रोजन पर आंशिक धनात्मक आवेश (δ .)+). तो यह एक अणु है इलेक्ट्रोनगेटिविटी अंतर के साथ और है ध्रुवीय:
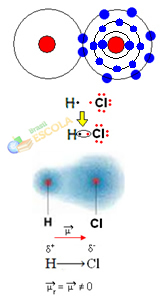
यह हमें दिखाता है कि इलेक्ट्रोनगेटिविटी एक निरपेक्ष मात्रा के बजाय एक सापेक्ष है, क्योंकि यह एक सहसंयोजक बंधन में परमाणुओं द्वारा लगाए गए बलों की तुलना को ध्यान में रखकर निर्धारित किया जाता है।
इलेक्ट्रोनगेटिविटी की गणना करने के कई तरीके हैं, लेकिन सबसे आम है पॉलिंग द्वारा प्रस्तावित इलेक्ट्रोनगेटिविटी स्केल। मान लें कि हमारे पास एक सामान्य अणु है ए बी. पॉलिंग ने प्रस्तावित किया कि डी के प्रतीक इस अणु की बाध्यकारी ऊर्जा बाध्यकारी ऊर्जा के अंकगणितीय माध्य के योग द्वारा दी जाएगी (डी) इन दो परमाणुओं के गैस अणुओं के, यानी ए-ए और बी-बी, उस अणु के प्रत्येक परमाणु की इलेक्ट्रोनगेटिविटी में अंतर के वर्ग के साथ (एक्स और xख):
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
घ(ए-बी) = [डी(ए-ए) + डी(बी-बी)]+k(x - एक्सख)2
उपरोक्त सूत्र में स्थिरांक k ९६.५ kJ के बराबर है। मोल-1. पॉलिंग ने हाइड्रोजन की वैद्युतीयऋणात्मकता के लिए एक मनमाना मान दिया, जो 2.1 था, और, इस तरह, के संबंध में अन्य तत्वों के इलेक्ट्रोनगेटिविटी मूल्य की खोज करना संभव था उसने।
इस पद्धति के आधार पर, महान गैसों के अपवाद के साथ, आवर्त सारणी के तत्वों के लिए पॉलिंग इलेक्ट्रोनगेटिविटी मान दिए गए थे।

ध्यान दें कि ये मान एक आवधिक गुण हैं क्योंकि वे समय-समय पर तत्वों की परमाणु संख्या के कार्य के रूप में भिन्न होते हैं। उदाहरण के लिए, देखें कि सबसे अधिक विद्युत ऋणात्मक तत्व तालिका के ऊपरी दाएं कोने में हैं, अर्थात फ्लोरीन (४.०) और ऑक्सीजन (३.५), और सबसे कम विद्युत ऋणात्मक वे हैं जो निचले बाएँ कोने में हैं, जो फ़्रांशियम (०.८) और सीज़ियम हैं (0,8).
इसके आधार पर, यह सबसे अधिक विद्युतीय तत्वों की इलेक्ट्रोनगेटिविटी की एक पंक्ति भी बनाई गई थी जो सबसे अधिक काम करती है:
F > O > N > Cℓ > Br > I > S > C > P > H
इलेक्ट्रोनगेटिविटी मान देखें:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
इलेक्ट्रोनगेटिविटी की इस पंक्ति को सजाने के लिए एक प्रकार की "ट्रिक" है, जो नीचे दिए गए वाक्य द्वारा दी गई है, जिसमें प्रत्येक शब्द का प्रारंभिक प्रश्न में तत्वों के प्रतीक से मेल खाता है:
“एफनमस्ते हेपास नहीं है नहींहे क्लोरीनउबे, बीआरमैंने पाया मैंरोंआहा सीमौत पीके लिए एचअस्पताल"
तो हम कह सकते हैं कि इलेक्ट्रोनगेटिविटी एक आवर्त गुण है जो आवर्त सारणी पर बाएं से दाएं और नीचे से ऊपर की ओर बढ़ता है।

यह परमाणु त्रिज्या के आकार के कारण है। एक परमाणु की त्रिज्या जितनी बड़ी होती है, साझा इलेक्ट्रॉन उसके नाभिक से उतने ही दूर होते हैं और इसलिए, उनके बीच का आकर्षण उतना ही कमजोर होता है। इसके विपरीत भी सच है, परमाणु त्रिज्या जितनी छोटी होगी, इलेक्ट्रॉन नाभिक के उतने ही करीब होंगे और उनके बीच आकर्षण उतना ही अधिक होगा। इस प्रकार, हम निम्नलिखित निष्कर्ष निकाल सकते हैं:
परमाणु त्रिज्या घटने के साथ वैद्युतीयऋणात्मकता बढ़ती है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक