आपके लिए. की घटना को समझने के लिए आयनीकरण सबसे पहले यह जानना आवश्यक है कि आयन क्या होते हैं। नीचे दिए गए स्पष्टीकरण पर ध्यान दें:
प्रत्येक परमाणु में प्रोटॉन और इलेक्ट्रॉनों की संख्या समान होती है; इसलिए, प्रत्येक परमाणु विद्युत रूप से तटस्थ होता है। इसके अलावा, परमाणुओं के समूहों द्वारा निर्मित पदार्थों में विद्युत आवेश संतुलन भी होता है, जो विद्युत रूप से तटस्थ होता है।
हालाँकि, एक परमाणु या परमाणुओं का समूह इलेक्ट्रॉनों को खो सकता है या प्राप्त कर सकता है; जब ऐसा होता है, तो वे तटस्थता खो देते हैं और आयन बन जाते हैं।
यदि परमाणु या परमाणुओं का समूह इलेक्ट्रॉनों को खो देता है, तो यह धनावेशित हो जाएगा और एक आयन होगा जिसे कहा जाता है कटियन. हालाँकि, यदि आप इलेक्ट्रॉन प्राप्त करते हैं, तो आवेश ऋणात्मक होगा और आयन होगा a ऋणायन.
अकार्बनिक पदार्थ आयनिक होते हैं या आयन बनाने की क्षमता रखते हैं।
आयनों को बनाने के तरीकों में से एक आणविक पदार्थों को पानी में रखना है, जो कि सहसंयोजक बंधों द्वारा बनता है, जिसमें इलेक्ट्रॉनों को साझा किया जाता है।
उदाहरण के लिए, यदि हम जलीय घोल (हाइड्रोजन क्लोराइड) में हाइड्रोक्लोरिक एसिड (HCl) के विद्युत प्रवाहकत्त्व का परीक्षण करते हैं पानी में घुल जाता है), हम देखेंगे कि घोल इलेक्ट्रोलाइटिक है, यानी यह विद्युत प्रवाह का संचालन करता है, क्योंकि इसमें आयन होते हैं समाधान।

इसका मतलब है कि पानी एक अभिकारक के रूप में कार्य करता है, जिससे हाइड्रोक्लोरिक एसिड से आयन बनते हैं। यह नीचे दी गई प्रतिक्रिया के अनुसार होता है:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
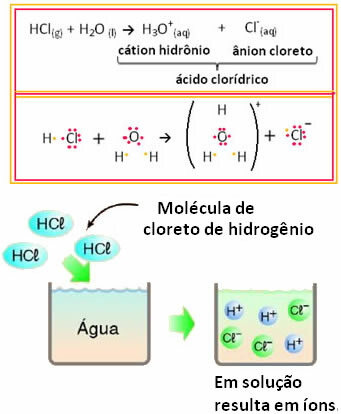
ध्यान दें कि हाइड्रोजन क्लोराइड को पानी में डालने से पहले आयन नहीं थे। हालांकि, इसके अणुओं ने पानी के साथ प्रतिक्रिया की और सकारात्मक एच आयनों का निर्माण किया3हे+ (उद्धरण) और ऋणात्मक Cl- (आयन)। चूंकि क्लोरीन हाइड्रोजन की तुलना में अधिक विद्युत ऋणात्मक है, यह अपने निकट सहसंयोजक बंधन से इलेक्ट्रॉनों की जोड़ी को आकर्षित करता है और आयन बनाता है। दूसरी ओर, हाइड्रोजन पानी में ऑक्सीजन द्वारा आकर्षित होता है, जो क्लोरीन की तुलना में अधिक विद्युतीय है; और हाइड्रोजन और ऑक्सीजन के बीच एक सहसंयोजक बंधन बनता है, जो हाइड्रोनियम केशन को जन्म देता है। आयन निर्माण की इस घटना को कहा जाता हैआयनीकरण.
उपरोक्त स्पष्टीकरण के आधार पर, हम आयनीकरण को निम्नानुसार परिभाषित कर सकते हैं:

ध्यान दें कि आयन पहले मौजूद नहीं थे, क्योंकि अगर वे मौजूद थे, जैसे कि आयनिक यौगिकों के विघटन के मामले में, हमारे पास एक आयनिक पृथक्करण होगा न कि आयनीकरण।
पानी के संपर्क में रखे गए सभी एसिड आयनीकरण से गुजरते हैं। हालांकि, प्रत्येक आणविक यौगिक आयनीकरण से नहीं गुजरता है।उदाहरण के लिए, चीनी (सी12एच22हे11) आणविक है, हालांकि, जब पानी में रखा जाता है, तो कोई आयन नहीं बनता है, यह बस घुल जाता है, जिससे एक गैर-इलेक्ट्रोलाइटिक आणविक समाधान उत्पन्न होता है, जो बिजली का संचालन नहीं करता है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "आयनीकरण"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/ionizacao.htm. 28 जून, 2021 को एक्सेस किया गया।