l'élément chimique phosphore (P) appartient à la troisième période du tableau périodique et à la famille de l'azote (VA). Pour cette raison, ses atomes font normalement trois liaisons chimiques pour atteindre le théorie de l'octet (stabilité). Cependant, il existe des situations dans lesquelles un atome de phosphore fait plus de trois liaisons, un fait qui n'est possible que grâce à la phénomène d'hybridation.
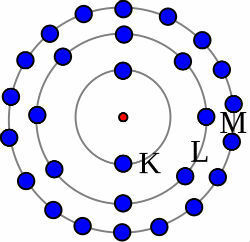
Pour comprendre le hybridation du phosphore, il faut d'abord comprendre pourquoi l'atome de cet élément fait trois liaisons. Pour cela, il nous suffit de surveiller votre diffusion électronique :

Distribution électronique de phosphore
On peut observer que, dans la couche de valence, l'atome de phosphore a le sous-niveau complet 3s (avec deux électrons) et le sous-niveau incomplet 3p (chacune des trois orbitales de sous-niveau p a un électron). Ci-dessous, nous avons la distribution des électrons dans les orbitales des sous-niveaux du Couche de valence phosphore:
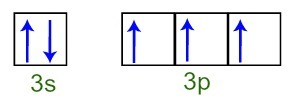
Représentation des électrons de la couche de valence de l'atome de phosphore
Comme chacune des orbitales de sous-niveau 3p est incomplète, l'atome de phosphore est capable de créer trois liaisons chimiques, assurant ainsi la stabilité.
Maintenant, quand on regarde la substance PCl5, par exemple, nous sommes certains que, dans cette molécule, le phosphore a subi une hybridation, puisqu'il a fait cinq connexions. Comme le chlore, qui appartient à la famille VIIA, a besoin d'une liaison pour être stable et la molécule a cinq atomes de ce élément, chacun d'eux doit faire une liaison, ce qui oblige l'atome de phosphore, à son tour, à faire également cinq Connexions. Cet événement n'est possible que par le hybridation (union d'orbitales atomiques incomplètes) du phosphore.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Lorsqu'ils reçoivent de l'énergie de l'environnement extérieur, les électrons de l'atome de phosphore sont excités. Peu de temps après, l'un des deux électrons appartenant au sous-niveau 3s se déplace vers une orbitale vide présente dans le sous-niveau d, qui jusque-là n'a pas d'électrons. Voir le schéma ci-dessous :
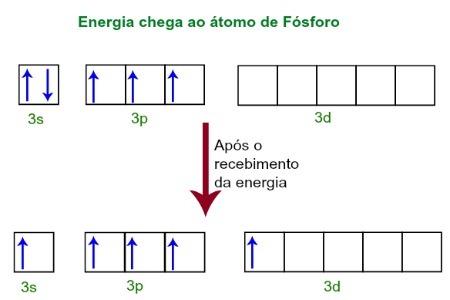
Lors de la réception de l'énergie, les électrons du phosphore sont excités et on occupe une orbitale du sous-niveau d.
A ce moment, nous avons dans la couche de valence du phosphore une orbitale s, trois orbitales p et une orbitale d incomplète.En fin de compte, ces cinq orbitales s'hybrident, c'est-à-dire fusionnent, ce qui donne cinq orbitales atomiques incomplètes, qui sont maintenant capables de créer cinq liaisons chimiques.

Hybridation des orbitales atomiques incomplètes du phosphore
En tant qu'orbitale s, trois orbitales p et une orbitale d ont été jointes, l'hybridation du phosphore est du type sp3ré.
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Hybridation du phosphore »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Consulté le 28 juin 2021.