Les acides et les bases sont deux groupes chimiques liés l'un à l'autre. Ce sont deux substances d'une grande importance et présentes dans la vie de tous les jours.
Les acides et les bases sont étudiés par la chimie inorganique, la branche qui étudie les composés qui ne sont pas formés par le carbone.
Concepts d'acides et de bases
Le concept d'Arrhénius
L'un des premiers concepts d'acides et de bases développé à la fin du 19ème siècle par Svante Arrhenius, un chimiste suédois.
Selon Arrhenius, les acides sont des substances qui, en solution aqueuse, souffrent ionisation, libérant sous forme de cations uniquement H+.
HCl (aq) → H+ (aq) + Cl- (ici)
Pendant ce temps, les bases sont des substances qui souffrent dissociation ionique, libérant comme seul type d'anion les ions OH- (hydroxyle).
NaOH (aq) → Na+ (aq)+OH- (ici)
Cependant, le concept d'Arrhenius pour les acides et les bases était limité à l'eau.
Lisez aussi à propos de: Théorie d'Arrhénius et Réaction de neutralisation.
Le concept de Bronsted-Lowry
Le concept de Bronsted-Lowry est plus large que celui d'Arrhenius et a été introduit en 1923.
Selon cette nouvelle définition, les acides sont des substances capables de donner un proton H+ à d'autres substances. Et les bases sont des substances capables d'accepter un proton H+ d'autres substances.
C'est le l'acide est un donneur de protons et la base est un récepteur de protons.
Il caractérise un acide fort comme celui qui s'ionise complètement dans l'eau, c'est-à-dire qu'il libère des ions H+.
Cependant, la substance peut être amphiprotique, c'est-à-dire capable de se comporter comme un acide ou socle de Bronsted. Regardez l'exemple de l'eau (H2O), une substance amphiprotique :
HNO3(aq) + H2O(l) → NON3- (aq) + H3O+(aq) = base de Bronsted, a accepté le proton
NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq) = acide de Bronsted, a fait don du proton
De plus, les substances se comportent comme paires conjuguées. Toutes les réactions entre un acide et un base de Bronsted impliquent le transfert d'un proton et ont deux paires acide-base conjuguées. Voir l'exemple :
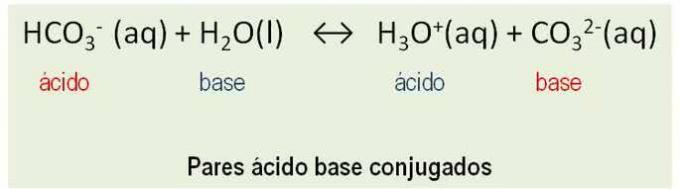
HCO3- et Cie32-; H2O et H3O+ sont des paires de bases d'acides conjugués.
En savoir plus sur:
- Fonctions inorganiques
- Indicateurs acido-basiques
- Titrage
Nomenclature des acides
Pour définir la nomenclature, les acides sont divisés en deux groupes :
- Hidacides: acides sans oxygène ;
- Oxyacides: acides avec oxygène.
Hidracides
La nomenclature se présente comme suit :
acide + nom de l'élément + hydrique
Exemples:
HCl = acide chlorhydrique
HI = acide iodhydrique
HF = acide fluorhydrique
oxyacides
La nomenclature des oxyacides suit les règles suivantes :
Toi acides standards de chaque famille (familles 14, 15, 16 et 17 du tableau périodique) suivent la règle générale :
acide + nom de l'élément + ic
Exemples:
HClO3 = acide chlorique
H2SEUL4 = acide sulfurique
H2CO3: acide carbonique
Pour les autres acides qui se forment avec le même élément central, nous les nommons en fonction de la quantité d'oxygène, en suivant la règle suivante :
| Quantité d'oxygène, par rapport à l'acide standard | Nomenclature |
|---|---|
| + 1 oxygène | Acide + per + nom de l'élément + ico |
| - 1 oxygène | Acide + nom de l'élément + os |
| - 2 oxygènes | Acide + hypo + nom de l'élément + os |
Exemples:
HClO4 (4 atomes d'oxygène, un de plus que l'acide standard): acide perchlorique ;
HClO2 (2 atomes d'oxygène, un de moins que l'acide standard): acide chloreux ;
HClO (1 atome d'oxygène, deux de moins que l'acide standard): acide hypochloreux.
Vous pouvez également être intéressé par: acide sulfurique
Nomenclature de base
Pour la nomenclature de base, la règle générale est suivie :
Nom de l'hydroxyde + cation
Exemple:
NaOH = Hydroxyde de sodium
Cependant, lorsqu'un même élément forme des cations avec des charges différentes, le numéro de la charge de l'ion est ajouté à la fin du nom, en chiffres romains.
Ou, vous pouvez ajouter le suffixe -oso, à l'ion le moins chargé, et le suffixe -ico, à l'ion le plus chargé.
Exemple:
Le fer
Foi2+ = Fe(OH)2 = hydroxyde de fer II ou hydroxyde ferreux;
Foi3+ = Fe(OH)3 = Hydroxyde de fer III ou Hydroxyde ferrique.
Assurez-vous de vérifier les questions d'examen d'entrée sur le sujet, avec une résolution commentée, dans: Exercices sur les fonctions inorganiques.


