Comme indiqué dans le texte "Équation chimique», pour représenter les réactions chimiques et comprendre leur traitement, leurs aspects quantitatifs et qualitatifs, il a été convenu d'utiliser des équations chimiques. Les équations chimiques contiennent des symboles et des nombres qui montrent quelles substances sont présentes et les proportions appropriées dans lesquelles elles réagissent.
Grâce à l'interprétation de ces équations, il est possible de trouver des données importantes qui nous aident à effectuer des calculs stœchiométriques. Cependant, la première étape dit que l'équation doit être équilibrée, c'est-à-dire que le nombre total d'atomes des réactifs doit être égal à celui des produits. Vous pouvez comprendre comment effectuer cet équilibrage à travers le texte "Équilibrage des équations”.
Avant, cependant, comprenez quelques concepts importants dans ce cas, comme la signification des termes: indice, coefficient stoechiométrique et mol. Ces termes seront expliqués ci-dessous et nous donneront un meilleur aperçu de la partie quantitative de la réaction :
- Indice: est le nombre qui indique le nombre d'atomes de chaque élément présent dans les formules chimiques. Ce numéro vient à droite de l'élément en question et apparaît en indice, c'est-à-dire dans une taille de police plus petite.
Exemple:
H2O (formule chimique de la substance aqueuse)
Qu'est-ce que ça veut dire:
- Les éléments qui composent cette substance sont H (hydrogène) et O (oxygène).
- L'indice de chaque élément indique combien d'atomes de chacun sont présents dans la formule de la molécule d'eau :
H2O→ O-index: il n'y a qu'1 atome d'oxygène.
↓
Indice H: indique qu'il y a 2 atomes d'hydrogène.
Notez que dans le cas de l'oxygène, il n'y a pas de nombre écrit, ce qui signifie qu'il n'y a qu'un atome de cet élément, comme expliqué ci-dessus.
Maintenant, il y a des cas où des parenthèses apparaissent dans les formules. Comment doit-on interpréter cela? Voir l'exemple ci-dessous :
Ici3(POUSSIÈRE4)2(formule chimique de la substance phosphate de calcium)
- La teneur en Ca indique qu'il y a 3 atomes de l'élément calcium présents dans la formule chimique ;
- Le P (phosphore) et O (oxygène) sont entre parenthèses, donc l'indice qui est à l'extérieur, qui dans ce cas est 2, appartient aux deux. Donc, pour savoir combien d'atomes de chacun il y a dans la formule, vous devez multiplier leurs indices séparément par l'indice extérieur. Notez comment cela se fait :

Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
P → indice 1 O → indice 4
p = 1. 2O = 4. 2
P = 2 O = 8
Il y a donc 2 atomes de phosphore et 8 atomes d'oxygène.
- Coefficient stœchiométrique: est le nombre qui précède la formule pour indiquer la quantité de chaque substance et la proportion de molécules participant à la réaction. Ainsi, comme dans le cas de l'indice, lorsque le coefficient est égal à 1, il n'est pas nécessaire de l'écrire, comme cela est implicite.
Exemple:
2H2 + 1O2 → 2 H2O (cette réaction de formation d'eau est illustrée dans la figure d'introduction)
↓ ↓ ↓
Coefficients de réaction
Dans cette équation, à travers les coefficients, il est montré que deux molécules d'hydrogène gazeux réagissent avec une d'oxygène gazeux, pour former deux molécules d'eau en tant que produit. Ainsi, le rapport stoechiométrique de cette réaction est de 2:1:2.
Pour connaître le nombre total d'atomes de chaque élément présents dans la réaction, il faut multiplier les coefficients par les indices de chaque élément :
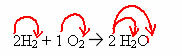
Réactifs :
H = 2. 2 = 4 atomes d'hydrogène
O = 1. 2 = 2 atomes d'oxygène
Produit:
H = 2. 2 = 4 atomes d'hydrogène
O = 1. 2 = 2 atomes d'oxygène
Notez que vous avez donné la même quantité aux réactifs et aux produits, ce qui signifie que la réaction est correctement équilibrée.
- Mol (quantité de matière) :dans une équation chimique, les coefficients sont considérés comme indiquant la quantité de mole ou la quantité de matière. Donc, dans le cas précédent on a 2 moles de H2 réagissant avec 1 mol d'O2, générant comme produits 2 moles de H2O.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Termes quantitatifs dans une équation chimique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Consulté le 27 juillet 2021.