La loi de Hess nous permet de calculer la variation d'enthalpie, qui est la quantité d'énergie présente dans les substances après avoir subi des réactions chimiques. En effet, il n'est pas possible de mesurer l'enthalpie elle-même, mais sa variation.
La loi de Hess sous-tend l'étude de la thermochimie.
Cette loi a été développée expérimentalement par Germain Henry Hess, qui a établi :
Le changement d'enthalpie (ΔH) dans une réaction chimique ne dépend que des états initial et final de la réaction, quel que soit le nombre de réactions.
Comment calculer la loi de Hess ?
Le changement d'enthalpie peut être calculé en soustrayant l'enthalpie initiale (avant la réaction) de l'enthalpie finale (après la réaction) :
H = HF -Hje
Une autre façon de le calculer est la somme des enthalpies dans chacune des réactions intermédiaires. Peu importe le nombre et le type de réactions.
H = ΔH1 + H2
Puisque ce calcul ne considère que les valeurs initiales et finales, il est conclu que l'énergie intermédiaire n'influence pas le résultat de sa variation.
Il s'agit d'un cas particulier de Principe de conservation de l'énergie, une Première loi de la thermodynamique.
Vous devez également savoir que la loi de Hess peut être calculée comme une équation mathématique. Pour ce faire, vous pouvez effectuer les actions suivantes :
- Inversez la réaction chimique, auquel cas le signe ΔH doit également être inversé ;
- Multipliez l'équation, la valeur de ΔH doit également être multipliée ;
- Divisez l'équation, la valeur de ΔH doit également être divisée.
en savoir plus sur enthalpie.
Diagramme d'enthalpie
La loi de Hess peut également être visualisée à travers des diagrammes énergétiques :
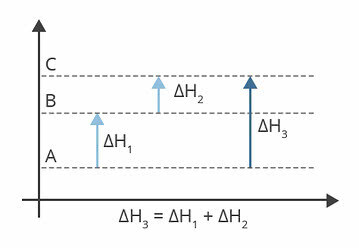
Le diagramme ci-dessus montre les niveaux d'enthalpie. Dans ce cas, les réactions subies sont endothermiques, c'est-à-dire qu'il y a absorption d'énergie.
H1 est le changement d'enthalpie qui se produit de A à B. Supposons qu'il soit de 122 kj.
H2 est le changement d'enthalpie qui se produit de B à C. Supposons qu'il soit de 224 kj.
H3 est le changement d'enthalpie qui se produit de A à C.
Il nous importe donc de connaître la valeur de ΔH3, car il correspond au changement d'enthalpie de la réaction de A à C.
On peut trouver la valeur de ΔH3, à partir de la somme des enthalpies dans chacune des réactions :
H3 = H1 + H2
H3 = 122 kj + 224 kj
H3 = 346 kj
Ou H = HF -Hje
H = 346 kj – 122 kj
H = 224 kj
Examen d'entrée: Résolu étape par étape
1. (Fuvest-SP) Basé sur les variations d'enthalpie associées aux réactions suivantes :
N2(g) + 2O2(g) → 2 NON2(g) H1 = +67,6 kJ
N2(g) + 2O2(g) → N2O4(g) H2 = +9,6 kJ
On peut prédire que la variation d'enthalpie associée à la réaction de dimérisation du NO2 sera égal à :
2 NO2(g) → 1 N2O4(g)
a) -58,0 kJ b) +58,0 kJ c) -77,2 kJ d) +77,2 kJ e) +648 kJ
Résolution:
Étape 1: Inversez la première équation. C'est parce que NON2(g) doit passer du côté des réactifs, selon l'équation globale. N'oubliez pas qu'en inversant la réaction, ∆H1 inverse également le signe, le changeant en négatif.
La deuxième équation est conservée.
2 NON2(g) → N2(g) + 2O2(g) H1 = - 67,6 kJ
N2(g) + 2O2(g) → N2O4(g) H2 = +9,6 kJ
Étape 2: Notez que N2(g) apparaît dans les produits et les réactifs et la même chose se produit avec 2 mol d'O2(g).
2 NON2(g) → N2(g)+ 2O2(g)H1 = - 67,6 kJ
N2(g) + 2O2(g) → N2O4(g) H2 = +9,6 kJ
Ainsi, ils peuvent être annulés, ce qui donne l'équation suivante :
2 NON2(g) → N2O4(g).
Étape 3: Vous pouvez voir que nous sommes arrivés à l'équation globale. Il faut maintenant additionner les équations.
H = H1 + ∆H2
H = - 67,6 kJ + 9,6 kJ
∆H = -58 kJ ⇒ Alternative A
De la valeur négative de ∆H nous savons aussi qu'il s'agit d'une réaction exothermique, avec dégagement de chaleur.
En savoir plus, lire aussi :
- Thermochimie
- Exercices sur la thermochimie
- Réactions endothermiques et exothermiques
- Deuxième loi de la thermodynamique
Des exercices
1. (UDESC-2012) Le méthane peut être utilisé comme combustible, comme le montre l'équation 1 :
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
En utilisant les équations thermochimiques ci-dessous, que vous jugez nécessaires, et les concepts de la loi de Hess, obtenez la valeur d'enthalpie de l'équation 1.
Ç(s) + H2O(g) → CO(g) + H2(g) H = 131,3 kJmol-1
CO(g) + ½ le2(g) → CO2(g) H = – 283,0 kJ mol-1
H2(g) + ½ le2(g) → H2O(g) H = – 241,8 kJ mol-1
Ç(s) + 2H2(g) → CH4(g) H = – 74,8 kJmol-1
La valeur d'enthalpie de l'équation 1, en kJ, est :
a) - 704,6
b) - 725,4
c) - 802.3
d) - 524,8
e) - 110,5
c) – 802.3
2. (UNEMAT-2009) La loi de Hess est d'une importance fondamentale dans l'étude de la thermochimie et peut être énoncée car « la variation de l'enthalpie dans une réaction chimique ne dépend que des états initial et final du réaction". Une des conséquences de la loi de Hess est que les équations thermochimiques peuvent être traitées algébriquement.
Étant donné les équations :
Ç (graphite) + O2(g) → CO2(g) H1 = -393,3 kj
Ç (Diamant) + O2(g) → CO2(g) H2 = -395.2 kj
Sur la base des informations ci-dessus, calculez le changement d'enthalpie du carbone graphite en carbone diamant et cochez la bonne alternative.
a) -788,5 kj
b) +1,9 kj
c) +788,5 kj
d) -1,9 kj
e) +98,1 kj
b) +1,9 kj