Le monoxyde de carbone est un gaz incolore, inodore, inflammable et toxique.
Sa formule moléculaire est CO. Il se compose d'une molécule de carbone et d'oxygène.
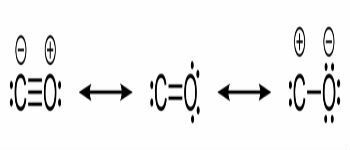
Formules structurelles du monoxyde de carbone et liaisons chimiques entre le carbone et l'oxygène
Il provient de deux manières :
- Sources de diffusion naturelles: activité des volcans, gaz naturel et décharges électriques.
- activités humaines: résultat de la combustion combustibles fossiles incomplets. La combustion produit des tonnes de CO, étant l'une des principales activités qui libèrent du CO dans l'atmosphère.
Caractéristiques
Le monoxyde de carbone appartient au groupe des oxydes. Il est classé comme oxyde neutre, ceux formés par un métal plus l'oxygène. De plus, il ne réagit pas avec l'eau, les acides et les bases.
Il est utilisé comme agent réducteur, il élimine l'oxygène d'un composé et produit le gaz carbonique (CO2). Par conséquent, son utilisation dans le traitement des minerais, comme le fer, est très courante. Ainsi que dans la production de substances organiques, telles que l'acide acétique, les plastiques, le méthanol, entre autres.
En réagissant avec l'oxygène de l'air, il produit du dioxyde de carbone. Selon la réaction chimique suivante: 2 CO + O2 → 2 CO2
Dans les eaux de surface, la forte concentration de monoxyde de carbone sert de source d'énergie pour les micro-organismes.
Le monoxyde de carbone est l'un des gaz de Effet de serre. Sa concentration dans l'atmosphère contribue à une meilleure rétention de la chaleur. Il est donc considéré comme un gaz polluant.
Intoxication
Le CO a une grande affinité pour l'hémoglobine. Comme il est toxique, son inhalation a des effets sur la santé humaine et peut même entraîner la mort.
Parce que le CO n'a pas d'odeur, il peut être inhalé inaperçu. Par conséquent, dans certains cas, la personne met beaucoup de temps à remarquer l'intoxication.
Lorsqu'il est inhalé à faible concentration, il provoque des migraines, un ralentissement de la pensée, une irritation des yeux et une perte de capacité manuelle. À des concentrations élevées, il peut provoquer des convulsions, une perte de conscience et même la mort par suffocation.
Mais comment se produit l'intoxication ?
LES hémoglobine se connecte, bien sûr, à l'O2 et le transporte vers les tissus du corps. Cependant, l'affinité entre le CO et l'hémoglobine est beaucoup plus grande, environ 250 fois plus qu'avec O2.
En présence de CO, l'hémoglobine s'y lie, empêchant le transport de l'oxygène vers les cellules. La combinaison du CO avec l'hémoglobine donne naissance à la carboxyhémoglobine.
Les principales causes d'intoxication au CO surviennent dans les situations suivantes :
- Moteurs de voitures fonctionnant à l'intérieur ;
- Brûlure de gaz naturel dans les appareils de chauffage inefficaces ;
- Échappement des gaz de la cuisine ou du four à bois, dans des zones mal ventilées.
Dans les pays au climat froid, les maisons ont tendance à rester fermées plus longtemps et à utiliser des systèmes de chauffage. Pour éviter les accidents de gaz, les détecteurs de CO sont de plus en plus utilisés.
En savoir plus, lire aussi :
- cycle du carbone
- Carbone
- Combustibles fossiles
- Oxygène