Une réaction d'oxydoréduction se caractérise par un processus simultané de perte et de gain d'électrons, car les électrons perdus par un atome, un ion ou une molécule sont immédiatement reçus par d'autres.
Pour comprendre, voir un exemple :
Une solution de sulfate de cuivre (CuSO4(aq)) est bleu en raison de la présence d'ions Cu2+ dissous dedans. Si nous mettons une plaque de zinc métallique (Zn(s)) dans cette solution, avec le temps on peut remarquer deux changements: la couleur de la solution deviendra incolore et un dépôt de cuivre métallique apparaîtra sur la plaque de zinc.
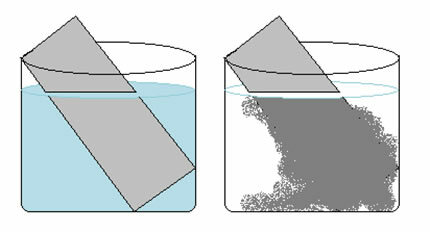
Par conséquent, la réaction qui se produit dans ce cas est la suivante :
Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
ou alors
Zn(s) + Cu2+(ici) + système d'exploitation42-(ici) → Cu(s) + Zn2+(ici) + système d'exploitation42-(ici)
ou encore
Zn(s) + Cu2+(ici) → Cu(s) + Zn2+(ici)
Notez qu'il y a eu un transfert d'électrons du zinc vers le cuivre. En analysant isolément la transformation qui s'est produite dans chacun de ces éléments, nous avons :
- Zn(s) → Zn2+(ici)
Le zinc a perdu 2 électrons en passant du zinc métallique au cation. Dans ce cas, le zinc a subi une oxydation.
- Cul2+(ici) → Cu(s)
Avec le cuivre, c'est l'inverse qui s'est produit, il a gagné 2 électrons, passant du cation cuivre II au cuivre métallique. Le cuivre a été réduit.
Ceci explique les deux changements observés, car la solution est devenue incolore car les ions de cuivre se sont transformés en cuivre métallique, qui s'est déposé sur la plaque de zinc.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Puisqu'il y avait une perte et un gain simultanés d'électrons, cette réaction est un exemple de réaction redox, et à travers elle, nous pouvons établir les concepts suivants qui sont répétés pour toutes les autres réactions de ce taper:

Le métal le plus réactif subit une oxydationAinsi, dans l'exemple proposé, le zinc est plus réactif que le cuivre.
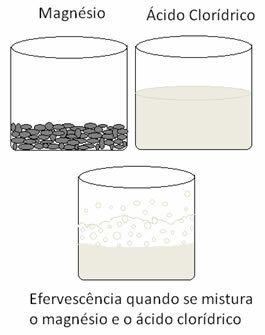
Une autre réaction redox que l'on peut citer se produit lorsque l'on met du magnésium ou de l'aluminium dans une solution d'acide chlorhydrique. Dans ces réactions, l'hydrogène de l'acide chlorhydrique reçoit 3 électrons de l'aluminium (ou 2 électrons du magnésium), en le faisant passer du cation H+ pour l'hydrogène gazeux (H2), tandis que le métal devient le cation :
2 Al(s) + 6H+(ici) → 2 Al3+(ici) + 3H2 (g)
mg(s) + 2H+(ici) → mg2+(ici) + H2 (g)
Les métaux subissent une oxydation et l'hydrogène subit une réduction. Voici une figure qui montre que l'ajout de magnésium à l'acide chlorhydrique provoque un l'effervescence, qui est due à la libération d'hydrogène gazeux, et le magnésium disparaît, car il est consommé.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Réactions d'oxydation »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Consulté le 28 juin 2021.
Chimie
Fonctionnement de l'airbag, dispositif conçu pour protéger les conducteurs, impulsion électrique, réaction de décomposition chimique, collision, mélange chimique d'azoture de sodium, capteurs situés sur le pare-chocs de la voiture, silicate alcalin, gaz azote.
Chimie

Verres photosensibles, réactions d'oxydo-réduction, perte ou gain d'électrons, verres photosynthétiques dans les lunettes de soleil, composition de verre photochromatique, atomes d'oxygène tétraédriques, structure cristalline du chlorure d'argent, lumière ultraviolette, métal argenté