Les éléments nommés d'après métaux alcalino-terreux sont ceux qui appartiennent à la famille 2 ou IIA, du tableau périodique. Ce groupe comprend les éléments chimiques suivants: Be (Béryllium), Mg (Magnésium), Ca (Calcium), Sr (Strontium), Ba (Baryum) et Radium (Ra).

Ils ont deux électrons dans la couche de valence, et leur distribution générique est représentée par ns2, où non représente le numéro du dernier niveau. En raison de cette caractéristique, ils ont tendance à perdre ces deux électrons, donnant lieu à des cations de charge 2+.
Le terme « terre » fait référence à « exister sur terre », car c'est là que ces éléments se trouvent, principalement dans les minéraux. Par exemple, le calcium, sous forme de composé de phosphate de calcium (Ca3(POUSSIÈRE4)2), se trouve dans la croûte terrestre et sert de matière première pour la production de phosphore. Il est également présent dans les os des animaux, à tel point que lorsque ceux-ci sont calcinés, on obtient ce qu'on appelle la « farine d'os », qui contient du phosphate de calcium.
Parmi les métaux alcalino-terreux, ceux qui se démarquent le plus sont les Calcium C'est le Magnésium.
- Calcium
L'ion calcium (Ca2+) est présent dans environ 90 % de nos os et de nos dents; et chez les animaux, il est également présent dans leurs coquilles. Sa fonction est de renforcer la structure osseuse et de servir de relaxant musculaire. Le manque de calcium dans le corps peut provoquer des crampes musculaires, le tétanos et l'ostéoporose. C'est pourquoi il est important de le consommer à travers des aliments riches en calcium, comme le lait et ses dérivés (beurre, fromage, etc.), la viande et les légumes.
D'un autre côté, trop de calcium peut provoquer un relâchement musculaire, des calculs rénaux et des douleurs osseuses.
En plus des aliments susmentionnés, le calcium est encore présent dans de nombreuses parties de la nature, en particulier dans les minéraux tels que la calcite (CaCO3) ou le carbonate de calcium, qui est un constituant du calcaire et du marbre, et le marbre est utilisé dans la fabrication d'éviers, de statues, de sols et d'escaliers. Le carbonate de calcium est également le constructeur de stalactites et de stalagmites dans les grottes. Le calcium est également présent dans le gypse naturel (CaSO4. 2 heures2O), appelé gypse. Ce sel peut être déshydraté, donnant naissance au CaSO4 anhydre, qui est de la craie scolaire.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
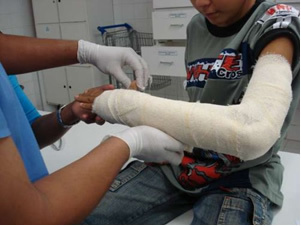
Dans l'industrie, on produit de la chaux vierge (CaO), de la chaux éteinte, également appelée chaux hydratée ou chaux éteinte, qui est en fait de l'hydroxyde de calcium (Ca(OH)2), utilisé dans les peintures à la chaux et dans la préparation du mortier. Le chauffage doux du gypse permet d'obtenir le sulfate de calcium hémihydraté, qui est du gypse, utilisé dans la construction dans la production de moules en dentisterie et en médecine pour protéger les fractures osseuses, comme celle du bras illustrée ci-dessous.
- Magnésium
l'ion de magnésium il a également une grande importance biologique, car il est présent dans 70% de nos os, favorisant l'action des enzymes, des muscles et de la coordination motrice. Son manque dans le corps peut provoquer une désorientation, une hypertension, des tremblements et un pouls faible. Par conséquent, nous devrions manger les aliments suivants qui contiennent cet élément: noix, céréales et légumes verts. En outre, un excès de magnésium dans le corps peut provoquer de la somnolence.
Le magnésium existe également dans l'eau de mer et les minéraux. Il est utilisé dans les alliages métalliques, tels que les métaux sacrificiels (qui s'oxydent à la place de l'acier, empêchant sa corrosion), dans les roues « magnésium » et dans les feux d'artifice (offrant les couleurs argent et blanc). Un composé très important du magnésium est l'hydroxyde de magnésium (Mg(OH)2), qui, dispersé dans l'eau, à une concentration d'environ 7 %, donne naissance à une suspension connue populairement comme lait de magnésie, qui sert d'antiacide, combat l'acidité de l'estomac (brûlures d'estomac) et comme laxatif.

Par Jennifer Fogaça
Diplômé en Chimie