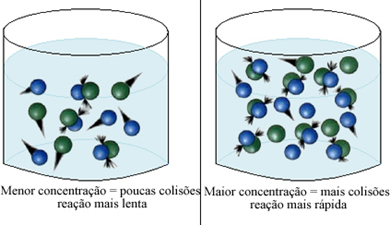
Nous pouvons noter que chaque fois que nous augmentons la concentration d'un ou de tous les réactifs participant à une réaction chimique, il y a une augmentation de sa vitesse de développement, c'est-à-dire la vitesse de la réaction.
L'inverse est également vrai. Par exemple, il est actuellement recommandé d'utiliser du gel hydroalcoolique au lieu de l'alcool ordinaire, car il y a moins de risque de combustion et d'éviter ainsi les accidents. L'alcool liquide ordinaire est en fait un mélange d'alcool et d'eau, l'alcool en gel contenant une plus petite quantité d'alcool. Par conséquent, lorsque la concentration de l'un des réactifs de combustion est réduite, dans le cas de l'alcool, la réaction se déroule plus lentement. En revanche, plus l'alcool est pur, plus la réaction de combustion est rapide.

Comme indiqué dans le texte Conditions de survenue de réactions chimiques, l'une des conditions pour qu'une réaction ait lieu est la collision efficace entre les particules. Ainsi, l'augmentation de la concentration des réactifs permet d'avoir une plus grande quantité de particules ou molécules confinées dans un même espace. Cela augmente le nombre de collisions entre eux et augmente également la probabilité que des collisions efficaces se produisent qui entraîneront la réaction. Le résultat est que la réaction a lieu plus rapidement.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Pour voir cela, pensez à l'exemple suivant: lorsque nous avons une braise qui brûle et que nous voulons que cette combustion se fasse plus rapidement, soufflons-nous ou soufflons-nous la braise? Pourquoi ça marche ?
Eh bien, l'un des réactifs de cette réaction de combustion est l'oxygène de l'air. Lorsque l'on secoue, le courant d'air évacue les cendres qui se forment lors de la combustion et cela facilite le contact de l'oxygène avec la braise. De cette façon, nous augmentons le contact entre les réactifs et accélérons la réaction de combustion.
Brièvement, nous avons :

Lorsque vous travaillez avec des gaz, une façon d'augmenter la concentration des réactifs est baisser la pression. Lorsque nous faisons cela, nous diminuons le volume et, par conséquent, il y a une augmentation des concentrations de réactifs.

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Concentration des réactifs et vitesse des réactions"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm. Consulté le 27 juin 2021.

