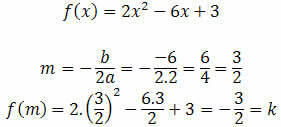molekyylien väliset voimat ne ovat tapoja, joilla kovalenttisten sidosten muodostamat yhdisteiden (polaaristen tai ei-polaaristen) molekyylit ovat vuorovaikutuksessa toistensa kanssa. Hollantilainen kemisti ja fyysikko Diderik Van der Waals ehdotti niitä vuonna 1873.
Van der Waalsin mukaan molekyylit voivat olla vuorovaikutuksessa eri tavalla. Nämä erilaiset vuorovaikutukset vaikuttavat suuresti sulamispiste (MP) ja kiehumispiste (PE) aineita. Siten intensiteetti, jolla molekyylit ovat vuorovaikutuksessa, määrittää niiden fysikaalinen olomuoto (kiinteä, nestemäinen tai kaasumainen)).
Erilaisten molekyylienvälisten voimien (vuorovaikutusten) olemassaolon havaitseminen on yksinkertaista, koska luonnossa voimme löytää saman aineen eri fysikaalisissa tiloissa. Tutustu nyt kolmen tyyppisiin molekyylien välisiin voimiin, joita voi olla kovalenttisten sidosten muodostamien aineiden välillä:
→ Lontoon joukot tai dipolin aiheuttamat
Se on sellainen voima, joka tapahtuu välillä ei-polaariset molekyylit
eli molekyylit, joilla ei ole napoja (positiivisia ja negatiivisia), koska elektronit jakautuvat tasaisesti sähköpallossaan, kuten alla olevassa kuvassa: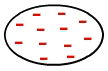
Elektronien tasainen jakautuminen ei-polaarisessa molekyylissä
Jossain vaiheessa elektronit voivat kuitenkin kerääntyä molekyylin alueelle ja luoda siihen negatiivisen ja positiivisen napan. Koska tämä molekyyli on lähellä toista, tämä väliaikainen dipoli saa päällekkäin toisen molekyylin elektronit kasaantumaan yhteen päähänsä ja niin edelleen:

Väliaikaisen dipolin muodostuminen ei-polaarisessa molekyylissä
Siten molekyyleillä, jotka eivät olleet polaarisia, on nyt indusoitu dipoli.
Ei-polaaristen molekyylien vuorovaikutus tapahtuu indusoituna
Joitakin esimerkkejä aineista, joiden molekyylit ovat vuorovaikutuksessa tämän tyyppisen voiman kanssa, ovat: hiilidioksidi (CO2), metaanikaasu (CH4), etaanikaasu (C2H6) ja vetykaasu (H2).
→ Pysyvä dipoli tai dipoli-dipoli vahvuus
Se on eräänlainen molekyylien välinen voima, joka tapahtuu välillä polaariset molekyylit (lukuun ottamatta niitä, joiden alkuaine vety on kytketty suoraan fluoriin, happeen tai typeen). Joitakin esimerkkejä aineista, joiden molekyylit ovat vuorovaikutuksessa dipoli-dipolin kanssa, ovat suolahappo (HCl), rikkidioksidi (SO2bromivetyhappo (HBr) ja syaanivetyhappo (HCN).
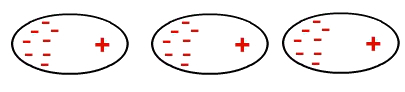
Koska molekyylit ovat polaarisia (niillä on positiivisia ja negatiivisia napoja), ne ovat vuorovaikutuksessa niin, että toisen negatiivinen napa yhdistyy toisen positiiviseen napaan ja niin edelleen:
Pysyvän dipolin esitys suolahappomolekyylien välillä
Dipolin läsnäolosta johtuen, koska molekyylit ovat polaarisia, dipoli-dipoli-vuorovaikutus on voimakkaampaa kuin indusoitu dipoli.
→ vetysidokset
Se on eräänlainen molekyylien välinen voima, jota esiintyy myös polaariset molekyylit, mutta vain, jos vetyatomi on suoraan yhteydessä johonkin kolmesta kemiallisesta alkuaineesta (fluori, happi ja typpi) sekä elektronegatiivit jaksollisen taulukon.
Joitakin esimerkkejä molekyyleistä, jotka ovat vuorovaikutuksessa vetysidosten kanssa, ovat: fluorivetyhappo (HF), ammoniakki (NH3) ja vesi (H2O).
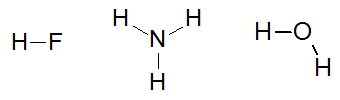
Rakennekaavat aineet fluorivetyhappo, ammoniakki ja vesi
Kuinka vety sitoutuminen tapahtuu molekyyleissä, joiden elektronegatiivisuusero atomien välillä on hyvin suuri suuri, se on korkean intensiteetin molekyylien välinen voima (suurempi kuin dipoli-dipoli ja dipoli aiheuttama).
Katso esitys tästä vuorovaikutuksesta:
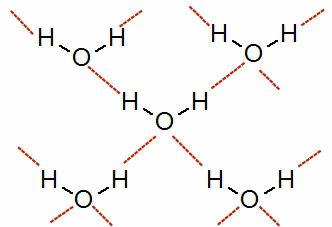
Edustus vetysidoksista vesimolekyylien välillä
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-forcas-intermoleculares.htm