määrittelee itsensä hybridisaatio epätäydellisten atomirataalien yhdistyminen. Kiertorata luokitellaan epätäydelliseksi, kun sillä on vain yksi elektroni sen sisällä kahden sijasta. Katso esitys keskeneräisestä ja täydestä kiertoradasta:

Kuvassa A on täydellinen kiertorata; kuvassa B epätäydellinen kiertorata.
Hybridisaatio on luonnollinen ilmiö, jota esiintyy joidenkin kemiallisten alkuaineiden kanssa, kuten fosfori, rikki, hiili jne. Hiilen hybridisaatio antaa tämän elementin atomien kyetä muodostamaan neljä kemiallista sidosta, ts. hiili muodostaa vain neljä sidosta hybridisoitumisen jälkeen.
Mutta miksi hiili hybridisoituu ja tekee neljä sidosta? Tämän ilmiön ymmärtämiseksi meidän on tiedettävä tämän elementin sähköinen jakelu:
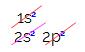
Hiilen elektronisessa jakelussa näemme, että 1s-alataso on täydellinen (kahdella elektronilla), 2s on täydellinen (kahdella elektronilla) ja 2p-alataso on epätäydellinen (p-alataso tukee kuutta elektronia, mutta vain kaksi). Jakamalla 2p-elektronit edustavalla tavalla meidän on:
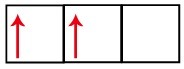
P-alatasolla on kolme kiertorataa - hiilen tapauksessa kaksi niistä on epätäydellisiä ja yksi on tyhjä. Tästä syystä tämän elementin tulisi suorittaa vain kaksi linkkiä, koska keskeneräisten kiertoradojen määrä määrää aina linkkien lukumäärän.
Saatuaan energiaa ulkoisesta ympäristöstä hiilessä olevat elektronit ovat kuitenkin innoissaan. Siten yksi alatason 2s elektroneista siirtyy alatason p kiertoradalle, joka oli tyhjä:
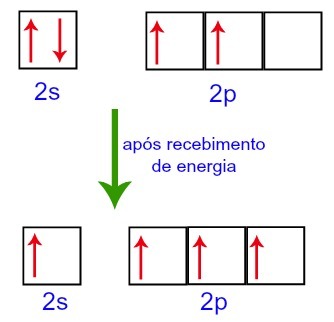
Hiili Orbitaalit ennen energian vastaanottamista ulkoisesta ympäristöstä ja sen jälkeen
Hiilelle jää siis neljä epätäydellistä orbitaalia toisella tasollaan. Sitten 2s-alatason orbitaali yhdistää kolme p-orbitaalia, mikä konfiguroi ilmiön hybridisaatio.
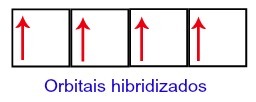
Hiiliradat hybridisaation jälkeen
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm