Niobium (Nb) on atomiluvun 41 kemiallinen alkuaine, joka kuuluu jaksollisen järjestelmän ryhmään 5.
Se on luonnollisesti saatavana kiinteässä tilassa oleva siirtymämetalli, jonka löysi vuonna 1801 brittiläinen kemisti Charles Hatchett.
Niobiumia sisältävät mineraalit ovat harvinaisia maailmassa, mutta runsaasti Brasiliassa, maassa, jossa on suurimmat tämän metallin varastot.
Ominaisuuksiensa, korkean johtokykynsä ja korroosionkestävyytensä ansiosta tällä elementillä on monia sovelluksia terästuotannosta rakettien valmistukseen.
Seuraavaksi esitellään tämä kemiallinen alkuaine ja ominaisuudet, jotka tekevät siitä niin tärkeän.
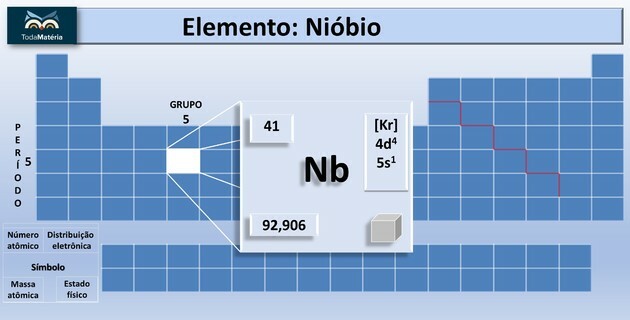
Mikä on niobium?
Niobium on tulenkestävä metalli, eli se kestää hyvin lämpöä ja kulutusta.
Tämän luokan metallit ovat: niobium, volframi, molybdeeni, tantaali ja renium, niobiumin ollessa kaikista kevyin.
Niobiumia esiintyy luonnossa mineraaleissa, jotka yleensä liittyvät muihin alkuaineisiin, pääasiassa tantaaliin, koska niillä on hyvin samanlaiset fysikaalis-kemialliset ominaisuudet.
Tämä kemiallinen alkuaine luokitellaan kausijärjestelmässä siirtymämetalliksi. Se on kirkas, matala kovuus, alhainen kestävyys sähkövirran kulkemiseen ja korroosionkestävä.
Niobiumin fysikaaliset ominaisuudet
| fyysinen tila | kiinteä huoneenlämpötilassa |
|---|---|
| väri ja ulkonäkö | metalliharmaa |
| Tiheys | 8,570 g / cm3 |
| Fuusiopiste | 2468 ° C |
| Kiehumispiste | 4742 ° C |
| Kiteinen rakenne | Kehon keskitetty kuutio - CCC |
lämmönjohtokyky |
54,2 W m-1 K-1 |
Niobiumin kemialliset ominaisuudet
| Luokitus | siirtymämetalli |
|---|---|
| atomiluku | 41 |
| Lohko | d |
| Ryhmä | 5 |
| Aikakurssi | 5 |
| atomipaino | 92,90638 u |
| atomisäde | 1,429 Å |
| tavalliset ionit | Huom5+ ja Nb3+ |
| elektronegatiivisuus | 1.6 Pauling |
Tämän metallin käytön tärkein etu on, että vain osa tästä elementistä voi grammoina muokata tonnia rautaa, mikä tekee metallista kevyemmän, kestää korroosiota ja paljon muuta tehokas.
Mistä Niobiumia löytyy?
Verrattuna muihin luonnossa esiintyviin aineisiin niobiumin pitoisuus on alhainen, 24 miljoonasosaa.
Tätä metallia löytyy seuraavista maista: Brasilia, Kanada, Australia, Egypti, Kongon demokraattinen tasavalta, Grönlanti, Venäjä, Suomi, Gabon ja Tansania.
Niobium Brasiliassa
1950-luvulla brasilialainen geologi Djalma Guimarães löysi tämän metallin sisältävän pyroklorimalmin suurimman kerrostuman Brasiliassa.
Suuri määrä niobiumia sisältäviä malmeja sijaitsee Brasiliassa, joka on maailman suurin tuottaja, jolla on yli 90% metallin varastoista.
Tutkittavat varannot sijaitsevat Minas Geraisin, Amazonasin, Goiásin ja Rondônian osavaltioissa.
niobiummalmit
Niobiumia esiintyy luonnossa aina yhteydessä muihin kemiallisiin alkuaineisiin. Yli 90 mineraalilajia, jotka sisältävät luonnossa niobiumia ja tantaalia, tunnetaan jo.
Alla olevassa taulukossa on joitain niobiumia sisältävistä malmeista, pääominaisuudet ja niobiumpitoisuus, jotka ovat käytettävissä jokaisessa materiaalissa.
| kolumbiittitaliitti | |
|---|---|
 | |
| Sävellys: | (Fe, Mn) (Nb, Ta)2O6 |
| Niobiumpitoisuus (enintään): | 76% Nb: stä2O5 |
| Ominaisuudet: |
|
| Pyrokloriitti | |
|---|---|
 | |
| Sävellys: | (Klo2,Tässä)2(Nb, Ti) (O, F)7 |
| Niobiumpitoisuus (enintään): | 71% Nb: stä2O5 |
| ominaisuudet: |
|
| Lopariitti | |
|---|---|
 | |
| Sävellys: | (C, Na, C)2(Ti, Nb)2O6 |
| Niobiumpitoisuus (enintään): | 20% Nb: stä2O5 |
| Ominaisuudet: |
|
niobiumin etsintä
Niobiummalmit muuttuvat, kunnes kaupan pidettävät tuotteet muodostuvat.
Prosessin vaiheet voidaan tiivistää seuraavasti:
- Kaivostoiminta
- Niobiumpitoisuus
- Niobiumin jalostus
- Niobium tuotteet
Kaivos tapahtuu siellä, missä on malmivarantoja, jotka uutetaan räjähteillä ja kuljetetaan vyöillä pitoisuusvaiheeseen.
Pitoisuus tapahtuu malmin hajoamisen yhteydessä, jauhamalla malmikiteistä tulee paljon hienompia ja käyttämällä magneettierotus rautafraktiot poistetaan malmista.
Niobiumin jalostuksessa rikki, vesi, fosfori ja lyijy poistetaan.
Yksi niobiumia sisältävistä tuotteista on rauta-niobiumseos, jota valmistetaan seuraavan yhtälön mukaisesti:
Tätä prosessia kutsutaan aluminotermiaksi, jossa malmitiiviste sekoitetaan reaktorissa rautaromun tai rautaoksidin kanssa.
Metallioksidit reagoivat alumiinin kanssa korkeissa lämpötiloissa, jolloin muodostuu kiinnostava tuote.
Kaupallisimmat niobiumtuotteet ovat:
- Niobiumtiivisteet: emäs, joka sisältää 58% Nb: tä2O5.
- Rauta-niobiumseos: sisältää 65% niobiumia.
- Erittäin puhdas oksidi: käytetään erikoismateriaalien valmistuksessa.
Mihin niobium on tarkoitettu?
Niobiumin ominaisuudet tekevät tästä elementistä yhä toivottavamman ja lukemattomien sovellusten kanssa.
Niobiumin hakemuksia alettiin tutkia vuonna 1905, kun saksalainen kemisti Werner von Bolton tuotti alkuaineen puhtaassa muodossa.
50-luku oli niobiumisovellusten suuri etsintä, koska siihen saakka sitä ei tuotettu laajamittaisesti.
Tänä aikana kylmä sota herätti kiinnostusta metalliin, jota käytetään ilmailu- ja avaruustekniikan komponenteissa.
Alla on luettelo niobiumin käyttötavoista.
Metalliseokset

Niobiumin lisääminen seokseen lisää sen kovettuvuutta, toisin sanoen kykyä kovettua, kun se altistetaan lämmölle ja sitten jäähdytetään. Niinpä niobiumia sisältävälle materiaalille voidaan suorittaa erityisiä lämpökäsittelyjä.
Niobiumin affiniteetti hiilin ja typen kanssa suosii seoksen mekaanisia ominaisuuksia, mikä lisää esimerkiksi mekaanista lujuutta ja hankauskestävyyttä.
Nämä vaikutukset ovat hyödyllisiä, koska ne voivat laajentaa metalliseoksen teollista käyttöä.
Esimerkiksi teräs on metalliseos, jonka muodostaa rauta ja hiili. Niobiumin lisäämisellä tähän seokseen voi olla etuja:
- Autoteollisuus: kevyemmän ja törmäyksenkestävämmän auton valmistus.
- Rakentaminen: parantaa teräksen hitsattavuutta ja antaa muokattavuuden.
- Liikenneputkiteollisuus: Sallii rakenteet, joiden seinät ovat ohuemmat ja halkaisijat suurempia, vaikuttamatta turvallisuuteen.
superseokset

Superseos on metalliseos, jolla on korkea vastustuskyky korkeille lämpötiloille ja mekaaninen lujuus. Niobiumia sisältävät seokset tekevät tästä materiaalista hyödyllisen lentoturbiinien valmistuksessa tai energiantuotannossa.
Korkeissa lämpötiloissa toimimisen etu saa superseokset muodostamaan tehokkaita suihkumoottoreita.
suprajohtavat magneetit

Niobiumin suprajohtavuus aiheuttaa niobium-germaniumin, niobium-skandiumin ja niobium-titaanin yhdisteiden käytön:
- MRI-laitteiden skanneri.
- Hiukkaskiihdyttimet, kuten Large Hadron Collider.
- Sähkömagneettisen säteilyn havaitseminen ja kosmisen säteilyn tutkiminen niobiumnitriittiä sisältävillä materiaaleilla.
Oksidit
Muita niobiumin käyttökohteita ovat oksidit, pääasiassa Nb2O5. Tärkeimmät käyttökohteet ovat:
- optiset linssit
- Keraamiset kondensaattorit
- pH-anturit
- moottorin osat
- Korut
Niobiumin historia ja löytö
Vuonna 1734 jotkut John Winthropin henkilökohtaiseen kokoelmaan kuuluvat malmit vietiin Amerikasta Englantiin, ja nämä tuotteet olivat osa Lontoon British Museumin kokoelmaa.
Kun hän liittyi Royal Societyn jäseneksi, brittiläinen kemisti Charles Hatchett keskittyi tutkimaan museossa olevien malmien koostumusta. Näin hän eristää vuonna 1801 kemiallisen alkyylin oksidin muodossa ja nimitti sen kolumbiumiksi ja malmiksi, josta se uutettiin.
Vuonna 1802 ruotsalainen kemisti Anders Gustaf Ekeberg ilmoitti uuden kemiallisen alkuaineen löytämisestä ja nimesi tantaaliksi viitaten Zeuksen poikaan kreikkalaisessa mytologiassa.
Vuonna 1809 englantilainen kemisti ja fyysikko William Hyde Wollaston analysoi nämä kaksi elementtiä ja havaitsi, että niillä oli hyvin samanlaiset ominaisuudet.
Tästä johtuen vuosina 1809-1846 kolumbiumia ja tantaalia pidettiin samana elementtinä.
Myöhemmin saksalainen mineralogi ja kemisti Heinrich Rose, tutkien kolumbiittimalmia, totesi, että tantaalia oli myös läsnä.
Rose löysi toisen tantaalia muistuttavan elementin läsnäolon ja kutsui sitä Niobiukseksi viitaten Kreikan mytologiasta Tantaloksen tytär Niobeen.
Vuonna 1864 ruotsalainen Christian Bromstrand onnistui eristämään niobiumin vetyatmosfäärissä kuumennetusta kloridinäytteestä.
Vuonna 1950 puhtaan ja sovelletun kemian liitto (IUPAC) hyväksyi niobiumin viralliseksi nimeksi kolumbiumin sijasta, koska ne olivat sama kemiallinen alkuaine.
Niobium-yhteenveto
Kemiallinen alkuaine: Niobium | |||
|---|---|---|---|
| Symboli | Huom | Löytäjä | Charles Hatchett |
| atomiluku | 41 | atomimassa | 92,906 u |
| Ryhmä | 5 | Aikakurssi | 5 |
| Luokitus | siirtymämetalli | Eletroninen jakautuminen | [Kr] 4d35s2 |
| ominaisuudet |
|
||
| Päämalmit |
|
||
| Päätuotteet |
|
||
| sovellukset |
|
||
| Tapahtuma | Maailmassa |
|
|
| Brasiliassa |
|
Enem-harjoitukset ja pääsykokeet
1. (Enem / 2018) Kreikkalaisessa mytologiassa Niobia oli Tantaloksen tytär, kaksi kärsimyksestä tunnettua hahmoa. Kemiallisen elementin atomiluvulla (Z) 41 on kemialliset ja fysikaaliset ominaisuudet, jotka ovat niin samanlaisia kuin alkuaineen atomiluku 73, että ne sekoittuivat.
Siksi näiden kahden hahmon kunniaksi kreikkalaisessa mytologiassa näille elementeille annettiin niobiumin (Z = 41) ja tantaalin (Z = 73) nimet. Nämä kaksi kemiallista alkuaineita ovat saaneet suuren taloudellisen merkityksen metallurgiassa, metallin valmistuksessa suprajohteissa ja muissa huippuluokan teollisuuden sovelluksissa nimenomaan kemiallisten ja fysikaalisten ominaisuuksiensa vuoksi molemmille yhteisiä.
KEAN, S. Katoava lusikka: ja muita todellisia tarinoita hulluudesta, rakkaudesta ja kuolemasta kemiallisista alkuaineista. Rio de Janeiro: Zahar, 2011 (mukautettu).
Näiden alkuaineiden taloudellinen ja tekninen merkitys johtuu niiden kemiallisten ja fysikaalisten ominaisuuksien samankaltaisuudesta
a) elektronien on oltava alatasolla f.
b) olla sisäisen siirtymän elementtejä.
c) kuuluvat samaan ryhmään jaksollisessa taulukossa.
d) uloimpien elektroniensa tasot 4 ja 5, vastaavasti.
e) sijaittava maa-alkalimetalli- ja emäksisissä perheissä.
Oikea vaihtoehto: c) kuuluvat samaan ryhmään jaksollisessa taulukossa.
Jaksotaulukko on jaettu 18 ryhmään (perheeseen), joissa jokainen ryhmä yhdistää kemialliset alkuaineet, joilla on samanlaiset ominaisuudet.
Nämä yhtäläisyydet tapahtuvat, koska ryhmän elementeillä on sama määrä elektroneja valenssikuoressa.
Suorittamalla sähköinen jakelu ja lisäämällä elektronit energisimmältä alatasolta uloimpaan alatasoon löydämme ryhmän, johon nämä kaksi elementtiä kuuluvat.
| Niobium | |
|
Jakelu elektroniikka |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p65s2 4d3 |
|
summa elektronit |
energisempi + ulkoisempi 4d3 + 5 sekuntia2 = 5 elektronia |
| Ryhmä | 5 |
| Tantaali | |
|
Jakelu elektroniikka |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f145d3 |
|
summa elektronit |
energisempi + ulkoisempi 5d3 + 6 s2 = 5 elektronia |
| Ryhmä | 5 |
Aineosat niobium ja tantaali:
- He kuuluvat samaan ryhmään jaksollisessa taulukossa.
- Heidän uloimmat elektroninsa ovat vastaavasti tasoilla 5 ja 6, ja siten ne sijaitsevat 5. ja 6. jaksossa.
- Heillä on elektroneja d-alatasolla, ja siksi ne ovat siirtymäelementtejä ulkopuolella.
2. (IFPE / 2018) Brasilia on maailman suurin niobiumin tuottaja, jonka osuus tämän metallin varannosta on yli 90%. Niobiumia, symbolia Nb, käytetään erikoisterästen valmistuksessa ja se on yksi korroosion ja äärilämpötilojen kestävimmistä metalleista. Nb-yhdiste2O5 se on lähes kaikkien seosten ja niobiumyhdisteiden edeltäjä. Valitse vaihtoehto vaaditulla Nb-massalla2O5 saaden 465 grammaa niobiumia. Annettu: Nb = 93 g / mol ja O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Oikea vaihtoehto: e) 665 g
Niobiumin edeltäjäyhdiste on Nb-oksidi2O5 ja seoksissa käytetty niobium on alkuaine Nb-muodossa.
Siksi meillä on seuraava stökiometrinen suhde:
1 mooli Nb: tä2O5 tuottaa 2 moolia Nb: tä, koska niobiumoksidi muodostuu 2 tämän metallin atomista.
1. vaihe: Laske tuotettujen niobiummoolien määrä, joka vastaa 465 g.
Jos laskennalla näimme, että niobiumin massa vastaa 5 moolia, niin Nb: n moolien määrä2O5 käytetty on puolet tästä arvosta, koska:
2. vaihe: lasketaan niobiumoksidin moolimassa.
3. vaihe: Laske niobiumoksidin massa, joka vastaa 2,5 moolia.
3. (UECE / 2015) Brasilialla on 98% maailman niobiumvarastoista, jolla on lukuisia teollisia sovelluksia, kuten korujen valmistuksessa, hyperallergeeniset implantit, sähkökeramiikka, suprajohtavat magneetit, magneettikuvauskoneet, metalliseokset, erikoiskolikot ja teräs. Niobiumia varten tarkista alla olevat lausunnot ja valitse ainoa todellinen vaihtoehto.
a) Sen differentiaalielektroni sijaitsee viimeistä edellisessä kuoressa.
b) Se on edustava elementti.
c) Sen elektronegatiivisuus on pienempi kuin vanadiumilla.
d) Se kuuluu jaksollisen taulukon neljänteen jaksoon.
Oikea vaihtoehto: a) Sen differentiaalielektroni sijaitsee viimeistä edellisessä kuoressa.
Niobiumin sähköistä jakelua suoritettaessa voidaan nähdä, että sen differentiaalielektroni sijaitsee viimeistä edellisessä kuoressa.
Koska sillä on differentiaalielektroni d-alatasossa, se on ulompi siirtymäelementti.
Koska sen uloin taso on viidennessä kerroksessa, niobium sijaitsee taulukon viidennessä jaksossa.
Elektronegatiivisuus on ominaisuus, joka liittyy elementin kykyyn houkutella elektroneja, ja se vaihtelee sen mukaan atomisäde: mitä pienempi atomisäde, sitä suurempi vetovoima on elektronien suhteen ja sitä suurempi on elektronegatiivisuus.
Taulukkoa tarkasteltaessa elektronegatiivisuusarvoilla voidaan nähdä, että niobiumilla ja vanadiumilla on lähellä 1,6 Paulingin arvoa.
4. (UEA / 2014) Niobiumin luonnollinen isotooppi on 93Huom. Neutronien määrä tässä isotoopissa on
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Oikea vaihtoehto: b) 52.
Isotoopit ovat kemiallisen elementin atomeja, joilla on erilaiset massanumerot.
Atomimassa vastaa elementin protonien ja neutronien summaa.
Protonien lukumäärä edustaa kemiallisen elementin atomilukua, eikä isotooppien osalta se muutu.
Siten isotooppien massan vaihtelu tapahtuu neutronien erilaisen lukumäärän vuoksi.
Jos niobiumin atomiluku on 41, neutronien lukumäärä saadaan laskemalla:
5. (IFMG / 2015) Kemiallinen alkuaine niobium, Nb, on nimetty kreikkalaisen jumalattaren Nioben mukaan. Brasilia on maailman suurin metallintuottaja, jonka osuus tuotannosta on 75%. Seosten lämpöstabiilisuuden vuoksi niobiumia käytetään erikoislujien terässeosten valmistuksessa moottoreille, käyttövoimalaitteille ja erilaisille suprajohtaville materiaaleille. Tarkkailemalla niobiumin sijaintia jaksollisessa taulukossa on oikein sanoa, että:
a) energisempi alatasosi on alataso d.
b) on alkalimetalliperheeseen kuuluva alkuaine.
c) muodostaa ionisia yhdisteitä muiden metallien kanssa.
d) sen kationien atomisäde on suurempi kuin puhtaan elementin.
Oikea vaihtoehto: a) energisempi alatasosi on alataso d.
Tarkasteltaessa jaksollista taulukkoa voidaan nähdä, että niobiumille on tunnusomaista ulompi siirtymäelementti, joka kuuluu jaksollisen järjestelmän ryhmään 5, koska sen energeettisin alataso on d.
Voimme myös saada nämä tiedot jakamalla ne sähköisesti.
Koska se on metalli, tämä elementti muodostaa metalliset yhteydet muiden metallien kanssa, kuten seoksessa rauta-niobium tai myös kovalenttiset sidokset jakamalla elektroneja, kuten niobiumoksidissa Huom2O5.
6. (UFSC / 2003) Niobiumin löysi vuonna 1801 englantilainen kemisti Charles Hatchett. Brasilian osuus maailman niobiumtiivisteen tuotannosta on noin 93%. Suurimmat talletukset sijaitsevat Minas Geraisin, Goiásin ja Amazonasin osavaltioissa. Metallia käytetään pääasiassa rauta-niobiumseosten ja muiden monimutkaisempien seosten valmistuksessa, joita on käytetty suihkumoottorien, rakettien ja avaruusalusten rakentamisessa. Sen oksideja käytetään silmälasien, valokuvakameroiden ja muiden optisten laitteiden valolinssien valmistuksessa. Annettu (Z = 41). Merkitse niobiumin kohdalla OIKEA ehdotus (ehdot).
(01) Niobium, menetettäessä 3 elektronia, olettaa kryptonin konfiguraation.
(02) Niobium voi muodostaa M-tyyppisiä metallioksideja2O5 sisään2O3.
(04) Niobiumin kemiallinen symboli on Ni.
(08) Niobium on siirtymämetalli.
(16) Rauta-niobiumseos on esimerkki kiinteästä liuoksesta.
Oikeat vaihtoehdot: 02 + 08 + 16 = 26.
(01) VÄÄRIN.
| Elementit | Eletroninen jakautuminen |
| 36Kr | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
|
41Huom 41Huom3+ |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d3 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4p6 4d2 |
(02) OIKEA
Kun otetaan huomioon niobiumin hapetusnumerot 3+ ja 5+, se voi muodostaa yhdisteet:
| Hapettumisnumero 5+ | Hapettumisnumero 3+ |
| Huom2O5 | Huom2O3 |
(04) VÄÄRIN
Ni on nikkelin elementin symboli. Niobiumin symboli on Nb.
(08) OIKEA
Niobium on ulkoinen siirtymämetalli, joka kuuluu jaksollisen järjestelmän ryhmään 5.
(16) OIKEA
Kiinteä liuos vastaa kahden tai useamman komponentin seosta samassa faasissa, joka on kiinteää ja yleistä metallien keskuudessa.
7. (UERJ / 2013) Niobium on metalli, joka löytyy luonnon kerrostumista, pääasiassa oksidien muodossa.
Niobiumia sisältävässä kerroksessa, jonka hapetusluku on +5, tämän metallin hallitsevan oksidin kaava vastaa:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Oikea vaihtoehto: d) Nb2O5
Happi muodostaa kaksi sidosta ja sillä on kiinteä hapetusluku, joka on 2.
Siksi niobiumoksidin muodostamiseksi hapen on sitoututtava tämän metallin kahteen atomiin.
Niobiumilla on erilaiset hapetustilat. Hapetusluvulla 3+ se sitoutuu 3 oksigeeniin ja Nox 5+: lla muodostaa yhdisteen: Nb2O5 jolloin 2 niobiumatomia sitoutuu 5 happiatomiin.
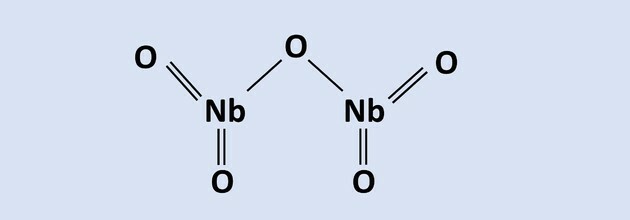
Lue teksti vastaamaan kysymyksiin 8-10.
Niobium on metalli, jolla on suuri tekninen merkitys, ja sen päävarannot maailmassa sijaitsevat
Brasilia pyrokloorimalmin muodossa, joka koostuu Nb: stä2O5. Aluminotermiaa käytetään yhdessä sen uuttavan metallurgian prosesseista Fe-oksidin läsnä ollessa2O3, jolloin saadaan sivutuotteena niobium ja rauta ja alumiinioksidi. Tämän prosessin reaktio on esitetty yhtälössä:
Luonnossa niobium esiintyy stabiilin niobium-93-isotoopin muodossa, mutta tunnetaan useita epävakaita synteettisiä isotooppeja, jotka hajoavat säteilyn päästöjen avulla. Yksi niistä on niobium-95, joka hajoaa elementiksi molybdeeni-95.
(Systems.dnpm.gov.br; Teknologia Metalli. Mater. Miner., São Paulo, v. 6, ei. 4, s. 185-191, huhti-kesäkuu. 2010 ja G. Audi ym. / Ydinfysiikka A 729 (2003) 3–128. Mukautettu)
8. (FGV / 2019) Niobiumin ja raudan seoksen saamiseksi aluminotermiareaktiossa, kun otetaan huomioon tasapainotetussa yhtälössä esitetty stökiometria, prosessiin osallistuvien elektronien kokonaismäärä on
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Oikea vaihtoehto: e) 36.
Redox-reaktio tapahtuu elektronien häviämisen ja vahvistumisen myötä.
Kun elementti pienenee, se saa elektroneja ja kun elementti hapettuu, se menettää elektroneja.
Kun alkuaine pelkistyy, se on hapettava aine, kun taas alkuaineen hapetessa se on pelkistin.
Tällä tavalla elektronien määrä, jotka yksi elementti on menettänyt ja luovuttanut toiselle, on yhtä suuri.
| Elementti | NOX | Reaktio | elektronit | |
| Niobium |
+5 3Huom2O5 |
0 6Nb |
Vähennys | 3.2.5 = 30 ja- voitot |
| Rauta |
+3 Usko2O3 |
0 2Fe |
Vähennys | 2,3 = 6 ja- voitot |
| Alumiini |
0 12Al |
+3 6Al2O3 |
Hapetus | 6.2.3 = 36 ja- menetetty |
Alumiinioksidituotteen alumiinivaraus on 3+ eli kukin alumiini on menettänyt 3 elektronia.
Tuotteissa on kuitenkin 12 alumiiniatomia, mikä tekee prosessiin osallistuvien elektronien kokonaismäärän:
12. 3 = 36 elektronia.
9. (FGV / 2019) Aluminotermiaoperaatiossa niobiumin ja rautaseoksen valmistamiseksi stoikiometrisillä määrillä Nb2O5 ja Fe2O3 ja ylimääräisen metallisen alumiinin käyttö, muodostui 6,12 tonnia Al: a.2O3. Tässä operaatiossa arvioitujen niobiumin ja raudan määrien yhteenlaskettu määrä moolina on
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Oikea vaihtoehto: d) 8 × 104.
1. vaihe: lasketaan Al: n moolimassa2O3
2. vaihe: Laske Al: n moolien määrä2O3
3. vaihe: suorita stökiometriset suhteet.
Kemiallisessa yhtälössä näemme, että suhde on olemassa: 6 moolia niobiumia, 6 moolia alumiinia ja 2 moolia rautaa.
Muodostuneiden moolien lukumäärän suhteen mukaan meillä on:
Ja niobiumin ja raudan määrien summa moolina on:
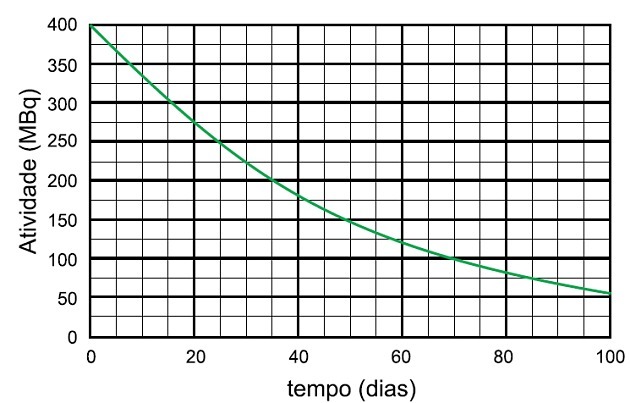
Niobium-95-radioisotooppien hajoamisprosessissa tämän näytteen aktiivisuuden hajoamiseen kuluva aika 25 MBq: iin ja päästetyn lajin nimi ilmoitetaan
a) 140 päivää ja neutronit.
b) 140 päivää ja protoneja.
c) 120 päivää ja protoneja.
d) 120 päivää ja hiukkasia ß–.
e) 140 päivää ja hiukkasia ß–.
Oikea vaihtoehto: e) 140 päivää ja hiukkasia ß–.
Puoliintumisaika on aika, jonka radioaktiivinen näyte kestää puolittamaan aktiivisuutensa.
Kaaviosta näemme, että radioaktiivinen aktiivisuus alkaa 400 MBq: sta, joten puoliintumisaika on aika, jonka aktiviteetti hajosi 200 MBq: iin, joka on puolet alkuperäisestä.
Analysoimme kaaviossa, että tämä aika oli 35 päivää.
Jotta aktiviteetti laskisi taas puoleen, kului vielä 35 päivää ja aktiivisuus nousi 200 MBq: sta 100 MBq: iin, kun kului vielä 35 päivää, toisin sanoen 400: sta 100 MBq: een 70 päivää.
Näytteen hajoamiseen 25 MBq asti vaadittiin 4 puoliintumisaikaa.
Mikä vastaa:
4 x 35 päivää = 140 päivää
Radioaktiivisessa hajoamisessa päästöt voivat olla alfa, beeta tai gamma.
Gammasäteily on sähkömagneettinen aalto.
Alfa-emissiolla on positiivinen varaus ja se vähentää 4 massayksikköä ja 2 yksikköä hajonneen elementin atomiluvussa muuttaen sen toiseksi elementiksi.
Beetapäästö on nopea elektroni, joka lisää hajonneen elementin atomiluvun yhdellä yksiköllä muuttaen sen toiseen elementiksi.
Niobium-95: llä ja molybdeeni-95: llä on sama massa, joten beetapäästö tapahtui, koska: