Tutkija Friedrich Kohlrausch (1840-1910) ehdotti ensimmäisenä, että puhdas vesi johtaa sähköä, vaikkakin pienessä mittakaavassa. Tämä johtuu siitä, että vesi käyttäytyy amfoteerisesti; toisin sanoen se toimii tietyissä tapauksissa kuten happo ja luovuttaa protoneja (H+); ja muissa se käyttäytyy kuin perusta, joka vastaanottaa protoneja.
Tämä tarkoittaa, että vesi suorittaa oman ionisaationsa alla esitetyn kemiallisen yhtälön mukaisesti:
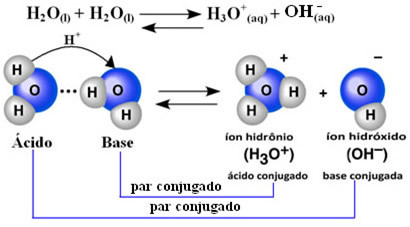
Tätä prosessia kutsutaan veden autoionisaatio ja sitä esiintyy hyvin pienessä mittakaavassa, toisin sanoen vesi on erittäin heikko elektrolyytti, jonka ionisointiaste ja ionisaatiovakio ovat pienet tasapainossa (Kç). Juuri siksi vedellä on niin alhainen johtavuus.
Voit antaa käsityksen siitä, että 25 ° C: n ympäristön lämpötilassa on mahdollista määrittää, että puhtaan veden itsensä ionisoinnissa syntyvät hydroksidi- ja hydroniumionien pitoisuudet ovat yhtä suuret. 10-7 mol. L-1. Tämä tarkoittaa, että miljardista vesimolekyylistä vain kaksi ionisoituu.
Veden ionitasapainovakiota kutsutaan
çveden dissosiaatiovakio,autoprotolyysivakiotai veden ionituote.Tätä vakiota edustaa Kw, koska w viittaa sanaan vettä, mikä englanniksi tarkoittaa vettä.Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Sen laskeminen tapahtuu samalla tavalla kuin muut tasapainovakiot, muistaen, että kuten tekstissä "Vakiot Balance Kc and Kp ”, tässä tapauksessa vain tuotteet näkyvät lausekkeessa, koska nestemäisessä vedessä on sama aktiivisuus 1: een. Puhtaita nestemäisiä tai kiinteitä aineita ei laiteta dissosiaatiovakioilmaan, koska ne eivät muutu. Vain vesipitoiset ja kaasumaiset liuokset asetetaan. Joten meillä on:
Kw = [H3O+]. [vai niin-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Kuten muillakin tasapainovakioilla, OKw se muuttuu vain lämpötilan muuttuessa. Veden lämpötilan noustessa myös sen ionisaatio kasvaa, mikä tarkoittaa, että veden itsensä ionisaatio on endoterminen prosessi, eli se absorboi lämpöä.
Tämä näkyy veden ionituotteen (Kw) annetaan alla olevassa taulukossa eri lämpötiloissa:
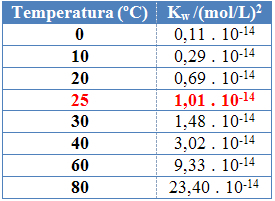
Veden ionituotteella on aina kiinteä arvo jokaisessa lämpötilassa, joko puhtaassa vedessä tai liuoksessa. Vaikka liuoksessa olisi H-ionipitoisuuksia3O+ ja oh- erilainen, niiden välinen tuote pysyy vakiona.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Ioninen vesituote (kW)"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Pääsy 28. kesäkuuta 2021.

