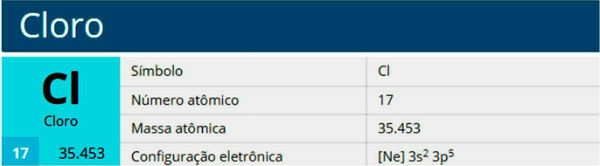
Kloor on keemiline element sümboliga Cl, aatomnumber 17, aatomimass 35,5. See kuulub halogeenide perekonda, rühma 17 või 7A, ja perioodilise tabeli kolmandasse perioodi.
Selle nimi tuleneb kreeka keelest khloros, mis tähendab rohekas. Seda seetõttu, et tavalistes temperatuuri ja rõhu tingimustes iseloomustatakse kloori kui rohekaskollast tugeva lõhnaga gaasi.
Funktsioonid
Kloori avastas 1774. aastal Rootsi teadlane Carl Wilhelm Scheele (1742–1786). Kuid toona uskusin, et see on hapnikuga ühend. Aastal 1810 näitas Humphry Davy (1778-1829), et see oli uus keemiline element.
Kuna tegemist on äärmiselt reaktiivse elemendiga, pole seda looduses puhtal kujul peaaegu üldse, välja arvatud vulkaanipursete ajal HCl kujul eralduv väike kogus.
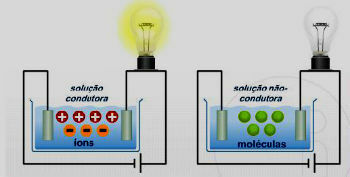
Seega leidub seda tavaliselt naatriumkloriidi (NaCl) kujul, mida nimetatakse ka lauasoolaks. Mineraalides esineb seda karnalliidi ja süviidi kujul.
Selle saab ka elektrolüüs NaCl vesilahuses. Kloor toodab kloriididest ka palju soolasid oksüdeerumine.
Lisateave, lugege ka:
- Perioodilisustabel
- Keemilised elemendid
- Halogeenid
rakendused
Gaasiline kloor (Cl2) on mürgine ja ärritav, selle seisundi tõttu kasutati seda 1. maailmasõja ajal keemiarelvana. See gaas põhjustab hingamisteede ja naha ärritust, veepeetust kopsudes, pisaraid ja suurtes kogustes sissehingamisel võib põhjustada surma.
Mõned muud kloori kasutusalad on:
- Paberi ja kangaste pleegitamine kloordioksiidiga (ClO2).
- Veepuhastus, kloori lisamine muudab vee joogikõlblikuks ja inimtoiduks kõlblikuks. Seda protsessi nimetatakse kloorimiseks ja kasutatakse hüpokloorhapet (HClO).
- Ujumisvee ja tööstusjäätmete desinfitseerimine, kuna kloor on võimeline hävitama mikroorganisme.
- Plastist ühendite nagu PVC (polüvinüülkloriid) ja sünteetilise kautšuki tootmine.
- Teatud tüüpi orgaaniliste ja anorgaaniliste ühendite tootmine.