Oksüdeerimine on keemiline reaktsioon, mille käigus aatomid, ioonid või molekulid kaotavad elektronid. See põhjustab ka oksüdatsiooni (nox) arvu suurenemist.
Mõiste oksüdeerumine loodi algselt reaktsioonide tähistamiseks, milles reaktiiviks oli hapnik. Siiski leiti, et mõnel juhul tekkisid need selle elemendi puudumisel. Kuna see termin oli juba laialt tuntud, jätkus selle kasutamine.
Oksüdatsioonireaktsioonid toimuvad samaaegselt redutseerimisreaktsioonidega. Seetõttu nimetatakse neid redoksiks, milles elektronid kanduvad.
Redoksreaktsioonides on oksüdeerija see, mis aktsepteerib elektrone, läbides redutseerimist. Redutseerija kaotab elektronid ja läbib oksüdeerumise.
Oksüdatsiooninäited
Raua oksüdeerimine
Rooste on raua oksüdeerumine. Kõik metallid võivad oksüdeeruda. See tekib metallide kokkupuutel õhu ja veega. Esialgu korrosioon mis on metalli oksüdatsioonist tingitud kulumine. Seejärel moodustab see rooste.
Vaadake redoks rooste moodustamiseks:
- Fe (s) → Fe2+ + 2e-. Selles etapis kaotab raud kaks elektroni, läbib oksüdeerumise
- O2 + 2 H2O + 4e- → 4OH-. O vähendamine2
- 2Fe + O2 + 2H2O → 2 Fe (OH)2. Üldvõrrand - Fe (OH)2 on raudhüdroksiid, mis vastutab rooste pruuni värvi eest.
Raua ja terase kaitsmiseks oksüdatsiooni eest saab kasutada tsingimistehnikat. See koosneb metallist tsinkkattest. See on aga kallis protsess, mistõttu on see mõnel juhul teostamatu.
Seega saavad laevade kered ja metallplatvormid metallist magneesiumiplokke, mis takistavad raua oksüdeerumist. Magneesiumi peetakse ohvrimetalliks ja see tuleb aeg-ajalt välja vahetada, kui see kulub.
Värvimine võib metalli kaitsta ka oksüdeerumise eest, kuid see pole nii tõhus.

Rooste
Loe ka Roostevaba teras ja Metallisulamid.
Orgaanilise keemia oksüdatsioon
Lisaks metallidele võib oksüdatsioon toimuda ka koos Süsivesinikud, eriti alkeenid. Orgaanilisel oksüdatsioonil on neli vormi: põlemine, osonolüüs, kerge oksüdatsioon ja energia oksüdatsioon.
Põlemine
THE põlemine see on aine keemiline reaktsioon hapnikuga, mis lõpeb valguse ja soojuse tekkimisega. Hapnikku nimetatakse oksüdeerijaks. Süsinikuga aine on kütus.
Hapnikul on oksüdeeriva kütuse funktsioon, see on põlemise oksüdeerija.
Põlemine võib olla täielik või mittetäielik. Tea, mis vahe on kahel viisil:
- Täielik põlemine: Tekib piisava hapnikuvaru korral. Reaktsiooni lõpus lisati süsinikdioksiid (CO2) ja vesi (H2O).
- Mittetäielik põlemine: Hapnikuvarustust pole piisavalt, need tekivad vingugaas (CO) ja vesi (H2O).
Osonolüüs
Seda tüüpi reaktsioonides on osoon reaktiiv, mis põhjustab alkeenide oksüdeerumist. Tekib alkeenide kaksiksideme purunemine ja karbonüülühendite, näiteks aldehüüdid ja ketoonid.
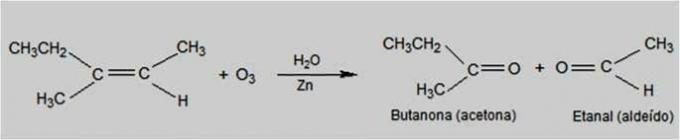
Osoonolüüsi reaktsioon
kerge oksüdeerumine
Kerge oksüdeerumine toimub siis, kui oksüdeerivaks aineks on selline ühend nagu kaaliumpermanganaat (KMnO4), mis on lahjendatud ja jahutatud, neutraalne või kergelt aluseline.
Seda tüüpi oksüdeerumine toimub Baeyeri testi abil, mida kasutatakse alkeenide eristamiseks isomeersetest tsüklaanidest.
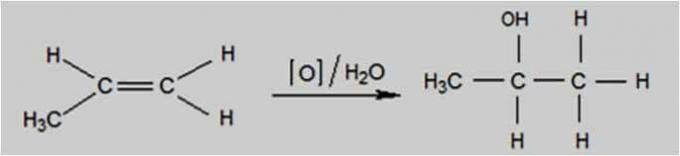
Kerge oksüdatsioonireaktsioon
Energia oksüdeerimine
Seda tüüpi oksüdatsiooni korral leidub kaaliumpermanganaati kuumemas ja happelisemas keskkonnas, mis muudab reaktsiooni energilisemaks. Energilised oksüdeerivad ained võivad lõhustada alkeenide kaksiksideme.
Sõltuvalt alkeeni struktuurist võivad moodustuda ketoonid ja karboksüülhapped.
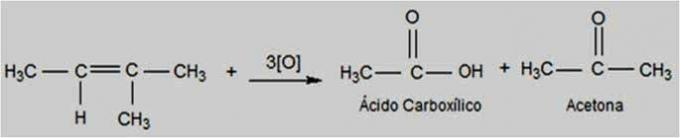
Energia oksüdatsioonireaktsioon
Kas soovite rohkem teada saada? Loe ka Elektrokeemia.



