Mõnes ühendis ei pea stabiilsuse saavutamiseks valentskoores olema kaheksa elektroni, mistõttu neid peetakse oktettreegli eranditeks. Siit saate teada, miks mõned elemendid pääsevad kohustusest omada viimases kestas elektronide oktetti.
Berüllium (Ole)
See on oktettreegli erand, kuna see on võimeline moodustama kahe üksiksidemega ühendeid, seega stabiliseerub valentskoores vaid nelja elektroniga. 
Kuna vesinik (H) peab sideme loomiseks loobuma kahest elektronist (H - Noh - H), jagab berüllium (Be) aatom oma elektrone ja saavutab stabiilsuse.
Alumiinium (Al)
See on oktettreegli erand, kuna see saavutab stabiilsuse valentsi kestas oleva kuue elektroniga. Alumiiniumi aatom kipub loovutama oma elektronid ja võib seega moodustada teiste aatomitega kolm üksiksidet: 
Sel juhul moodustas alumiinium (Al) kolm sidet kolme fluori (F) aatomiga.
Boor (B)
See moodustab kolme üksiksidemega molekulaarseid aineid. 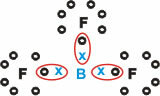
Pange tähele, et boor (B) kipub annetama oma elektronid fluori (F) aatomitele, mis täidavad oktettireeglit, nõudes valentskoores kaheksa elektroni. Kui boor loobub oma elektronidest, stabiliseerub fluor moodustunud oktetiga.
Autor Líria Alves
Lõpetanud keemia
Brasiilia koolimeeskond
Ärge lõpetage kohe... Peale reklaami on veel;)
Näe rohkem!
Okteti teooria
Üldkeemia - Keemia - Brasiilia kool
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
SOUZA, Líria Alves de. "Kaheksandikureegli erandid"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm. Juurdepääs 27. juunil 2021.



