Lorenzo Romano Amedeo Carlo Avogadro (1776–1856) oli Itaalia keemik, kes tõi esmalt välja idee, et elemendi proovil, mille mass grammides on arvuliselt võrdne aatomimassiga, on alati sama arv aatomeid (N).
Avogadro ise ei suutnud N väärtust määrata. Kuid kogu 20. sajandi jooksul võimaldas tehnoloogia ja teaduslike teadmiste areng teistel teadlastel selle väljatöötamiseks tehnikaid välja töötada. Kui see väärtus lõpuks avastati, siis see helistati Avogadro konstant, selle teadlase auks, kuna just tema pani aluse selle loomisele.

Lorenzo Romano Amedeo Carlo Avogadro (1776–1856)
1 mool üksust (aatomid, molekulid, elektronid, valemid või ioonid) sisaldab täpselt Avogadro konstandi väärtust.
Allolevas tabelis on toodud mõned 20. sajandil saadud Avogadro konstandi väärtused:
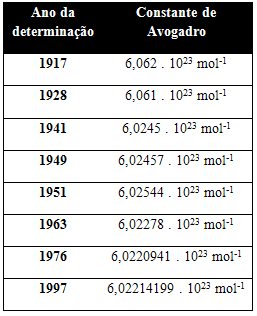
Siin on mõned meetodid, mida kasutatakse Avogadro konstandi väärtuse määramiseks:
Esimene teadlane, kes tegi Avogadro konstandi jaoks ligikaudse arvutuse, oli Johann Joseph Loschmidt. Aastal 1867 võttis ta aluseks gaaside kineetilise teooria ja tegi kindlaks, kui palju molekule eksisteeris 1 cm3 gaasi.
Teine neist teadlastest oli prantslane Jean Baptiste Perrin (1870–1942), kes luges suspensioonis kolloidsete osakeste arvu mahuühiku kohta ja mõõtis nende massi. Väärtus, mille ta leidis, oli vahemikus 6,5–7,2. 1023 üksused mooli kohta. See teadlane avaldas raamatu 1913. aastal Les Atomes (1. väljaanne Paris: Alcan) ja selle 1924. aastal ilmunud 9. väljaanne sisaldas 16 viisi Avogadro konstandi eksperimentaalseks saamiseks.
Ärge lõpetage kohe... Peale reklaami on veel;)

Jean Baptiste Perrin (1870–1942)
Aastaid hiljem kasutas teadlane James Dewar (1842–1923) aastaid varem radiokeemik Bertram Boltwoodi (1870–1927) ja füüsik Ernesti väljatöötatud meetodit Rutherford (1871–1937), mis seisnes põhimõtteliselt radioaktiivse allika kiirgatavate alfaosakeste loendamises ja saadud heeliumgaasi mahu määramises. Dewari leitud väärtus oli 6,04. 1023 mol-1.
Veel 20. sajandil viis Robert Millikan (1868-1953) läbi katse, et määrata elektroni laeng (1.6. 10-19 Ç). Kuna 1 mooli elektronide laeng oli juba teada (96500 C), oli võimalik need kaks väärtust omavahel seostada ja leida Avogadro konstandi jaoks järgmine väärtus: 6,03. 1023 mol-1.
Praegu on Avogadro konstandi soovitatav väärtus 6,02214 x 1023 mol-1 ja see määratakse röntgendifraktsiooni abil, mille tulemusel saadakse mõne kristallvõre aatomi maht seni, kuni proovis on teada ühe mooli aatomite tihedus ja mass.
Didaktilistel eesmärkidel loetakse Avogadro konstandi keskkoolis, kus arvutused ei pea olema nii täpsed kui keemialaborites, 6,02. 1023 mol-1.
On ka lihtsamaid meetodeid, mida saab kasutada õpilastel Avogadro konstandi kindlaksmääramiseks praktikas. Üks neist toimub elektrolüüsi teel vesikeskkonnas.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Avogadro konstandi määramine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Juurdepääs 28. juunil 2021.


