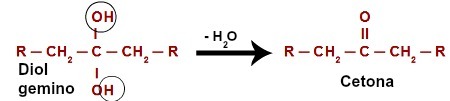
La tabla periódica existe para organizar elementos que tienen propiedades químicas y físicas similares. Los metales, semimetales, no metales y gases nobles forman grupos subdivididos para facilitar la localización.
Pero la Tabla Periódica no solo es útil para conocer la masa atómica, el número atómico y la distribución electrónica de los átomos, podemos usarla observar las propiedades periódicas y aperiódicas que se utilizan para relacionar las características de los elementos con sus estructuras. atómico.
Veamos cada uno en particular:
Propiedades periódicas: ocurren a medida que aumenta el número atómico de un elemento químico, es decir, asume valores que aumentan y disminuyen en cada período de la Tabla Periódica.
Las propiedades periódicas incluyen: radio atómico, energía de ionización, electroafinidad, electronegatividad, densidad, temperatura de fusión y ebullición y volumen atómico.
Demostración: la propiedad periódica de la electronegatividad crece de abajo hacia arriba y de izquierda a derecha de la tabla, ya que cuanto más pequeño es un átomo, mayor es su electronegatividad.
propiedades aperiódicas: los valores de esta propiedad varían a medida que aumenta el número atómico, pero no obedecen a la posición en la tabla, es decir, no se repiten en periodos regulares.
Ejemplos de propiedades aperiódicas: calor específico, índice de refracción, dureza y masa atómica. Vale la pena señalar que la masa atómica siempre aumenta de acuerdo con el número atómico del elemento y no concierne a la posición de este elemento en la Tabla.
No pares ahora... Hay más después de la publicidad;)
Por Líria Alves
Licenciada en Química
Equipo Escolar de Brasil
Vea mas:
Propiedades periódicas
Tabla periodica - Química - Escuela Brasil
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
SOUZA, Líria Alves de. "Propiedades periódicas y aperiódicas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/propriedades-periodicas-aperiodicas.htm. Consultado el 28 de junio de 2021.