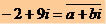El carbono es un elemento químico con un número atómico (Z) igual a 6, lo que significa que los átomos que lo forman tienen seis protones en su núcleo. Su masa molar es de 12.011 g / mol y en la naturaleza se encuentran tres isótopos de carbono, los cuales son: o carbono-12, carbono-13 y carbono-14. C-12 tiene seis protones y seis neutrones en el núcleo y es el más abundante.
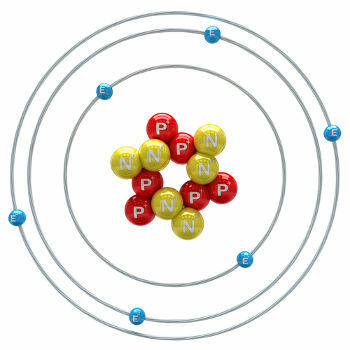
Ilustración de átomo de carbono-12
C-13 tiene siete neutrones y es el menos abundante (1.01 a 1.14%). El C-14 tiene ocho neutrones y es un elemento radiactivo que emite partículas β (electrones), formándose en la estratosfera de la Tierra cuando los neutrones de rayos cósmicos bombardean el Nitrógeno-14 presente en estas capas superiores de la atmósfera. Lo incorporan todas las plantas y animales y, sabiendo que su vida media es de unos 5730 años, se utiliza para determinar la edad de los fósiles entre 100 y 40.000 años. Se pueden ver más detalles sobre C-14 y la técnica de datación en el texto. ¿Qué es el carbono-14?
El carbono es tetravalente, es decir, necesita cuatro protones más en su capa de valencia (capa más externa) para obedecer la regla del octeto. Por lo tanto, generalmente forma cuatro enlaces covalentes, compartiendo cuatro pares de electrones con otros elementos y con otros carbonos. Estos enlaces pueden ser simples, dobles o triples y dan como resultado la formación de millones de compuestos diferentes. Por este motivo, se creó un área de Química, la Química Orgánica, que estudia los principales compuestos derivados del carbono, a excepción de algunos casos que son de origen mineral, como dióxido de carbono (CO2), O monóxido de carbono (CO), O carbonato de calcio (CaCO3), hidrogenocarbonato de sodio o bicarbonato de sodio (NaHCO3), entre otros. Estos compuestos se estudian en Química Inorgánica.
El carbono realiza alotropía, formando sustancias simples, es decir, sustancias que se forman solo por enlaces entre átomos de carbono. Hay al menos siete alótropos de carbono, que son grafito (alfa y beta), diamante, lonsdaleita (diamante hexagonal), chaoita, carbono (VI) y fullerenos. En realidad, existen varios tipos de fullerenos, que son formas alotrópicas sintéticas de carbono. Tienen una estructura poliédrica con un átomo de carbono en cada vértice y un ejemplo es el C60 llamada buckminsterfullereno, y su estructura parece una pelota de fútbol.
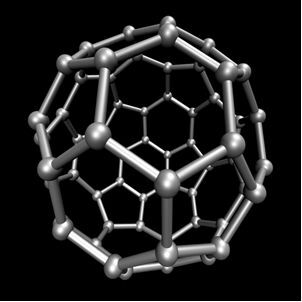
Carbono-60 (buckminsterfullereno)
Sin embargo, entre estos alótropos de carbono, solo hay dos que son naturales. grafitoes de Diamante. Se diferencian solo por la disposición cristalina de los átomos en el espacio, como se muestra en la figura siguiente, y esto da como resultado propiedades fisicoquímicas totalmente diferentes. Lea el texto alotropía de carbono para más informaciones.

Las dos formas alotrópicas naturales de carbono son el grafito y el diamante.
Otra forma alotrópica sintética de carbono es el nanotubos (imagen a continuación) que tienen amplias aplicaciones biológicas, incluidos diagnósticos y tratamientos médicos.

Ilustración de un nanotubo de carbono microscópico
Así, El carbono está presente en todo lo que nos rodea y dentro de nosotros., porque él compone compuestos orgánicos naturales - como los combustibles fósiles, que incluyen petróleo, carbón y gas natural, y otros combustibles como el etanol y los biocombustibles - productos agrícolas, entre otros. forma también compuestos orgánicos sintéticos, como fibras sintéticas que componen tejidos, medicinas, polímeros que componen plásticos y cauchos, insecticidas, tintes y mucho más. Dentro de nosotros, animales y vegetales, el carbono forma compuestos muy importantes, como los carbohidratos, como el azúcar, la glucosa y la celulosa; las proteínas que forman, por ejemplo, el ADN, y junto con los lípidos forman las membranas de los glóbulos rojos y los glóbulos blancos.
Todo esto muestra la importancia del carbono para sustentar la vida. Pero también se ha asociado a aspectos negativos, como la intensificación de la efecto invernadero y el consecuente calentamiento global, esto se debe a que el principal villano de estos problemas es su compuesto de dióxido de carbono (CO2). Principalmente debido a la gran quema de combustibles fósiles que liberan este gas, la concentración de CO2 en la atmósfera ha aumentado. Como gas de efecto invernadero, causa los problemas antes mencionados. Por otro lado, el dióxido de carbono también está presente en reacciones vitales como la fotosíntesis y la respiración.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-carbono.htm