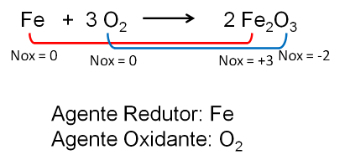
Støkiometri er beregningen af mængden af stoffer, der er involveret i en kemisk reaktion.Dette gøres ud fra reaktionslovene og udføres generelt ved hjælp af de tilsvarende kemiske ligninger. Dette ord, støkiometri, stammer fra græsk: stoikheion = element og metron = måling eller måling.
I kemiske reaktioner reagerer stoffer med hinanden med oprindelsesprodukter i bestemte proportioner. På denne måde er det muligt at beregne, hvor meget produkt der dannes eller reaktionsudbyttet. Hvis vi ønsker et bestemt udbytte, kan vi også beregne, hvor meget reagens der skal bruges.
Gennem støkiometriske beregninger er det muligt at lave disse og andre specifikke sammenhænge. Men først og fremmest er vi nødt til at kende de proportioner, der findes mellem de elementer, der udgør de forskellige stoffer. Og disse proportioner er givet ved molekylære formler, procenter og minimum eller empiriske.
Desuden er basis for koefficienterne for enhver reaktion vægtlove:
- Lov om massebeskyttelse- I et lukket system er den samlede masse af reaktanter lig med den samlede masse af produkterne;
- Lov med konstante proportioner- Hvert stof har en konstant masseandel i dets sammensætning.
Ud over Gay-Lussac volumetrisk lov det giver os også vigtig information: hvis trykket og temperaturen ikke ændres, har de gasmængder, der deltager i en reaktion, et forhold mellem hele og lille antal til hinanden.
Stop ikke nu... Der er mere efter reklamen;)
Forholdet vist nedenfor bruges i støkiometriske beregninger:
1 mol ↔ 6. 1023 molekyler eller enhedsformler ↔ molær masse i g / mol ↔ 22,4 L (i CNTP*) |
* Normale temperatur- og trykforhold.
Lad os se på et eksempel på en støkiometrisk beregning, hvor kun mængden af stof (mol) er relateret.
Eksempel:Hvad er mængden af ethylalkoholmateriale, C2H6O(1), som skal reagere for at give 12 mol kuldioxid? Overvej dette som en komplet forbrændingsreaktion.
Balanceret ligning:
Ç2H6O(1) + 3 O2(g) → 2CO2 (g) + 3 H2O(v)
Bemærk, at 1 mol alkohol producerer 2 mol kuldioxid, så du kan lave en simpel regel på tre for at løse problemet:
1 mol 2 mol
x12 mol
X = 6 mol
Svar: 6 mol ethylalkohol er nødvendig for at generere 12 mol kuldioxid.
Husk, at det også er muligt at relatere masse, antal molekyler og molært volumen. I alle disse tilfælde er det dog nødvendigt at følge følgende grundlæggende regler:

Grundlæggende regler for enhver støkiometrisk beregning.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Reaktionstoichiometri"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/estequiometria-reacoes.htm. Adgang til 27. juni 2021.