Americký chemik Gilbert N. Lewis (1875-1946) navrhl pravidlo oktetu, které říká:
"Atomy různých prvků vytvářejí chemické vazby, darují, přijímají nebo sdílejí elektrony, aby získaly elektronickou konfiguraci ušlechtilý plyn, tj. s 8 elektrony v posledním obalu (nebo se 2 elektrony v případě atomů, které mají pouze jeden elektronový obal, jak je tomu u vodík)."
V roce 1916 Lewis navrhl, aby zůstal stabilní a dosáhl oktetu nebo duetu, prvků, které tvoří molekulární látky provést sdílení párů elektronů. Tyto látky jsou tvořeny pouze atomy vodík, nekovy a polokovy, vše s tendence přijímat elektrony. Neexistuje tedy žádný způsob, jak by někdo z nich daroval jakýkoli elektron (jak je tomu u kovů v iontových vazbách), ale každý potřebuje přijímat, takže sdílí své elektrony prostřednictvím kovalentní vazby nebo molekulární.
Gilbert Lewis tedy navrhl způsob, jak reprezentovat kovalentní nebo molekulární vazbu, která se stala známou jako Lewisův vzorec. Také se jí říká elektronický vzorec nebo ještě
Lewisův elektronický vzorec, protože jeho hlavní charakteristikou je to, že ukazuje elektrony ve valenčním plášti každého atomu a tvorbu elektronických párů.Každý elektron je reprezentován tečkou., který obklopuje symbol příslušného chemického prvku. Pouze elektrony valenčního pláště jsou kolem prvku.
Jak je uvedeno v tabulce níže, znáte množství elektronů ve valenčním shellu, stačí znát rodinu Periodic Table:
Nepřestávejte... Po reklamě je toho víc;)

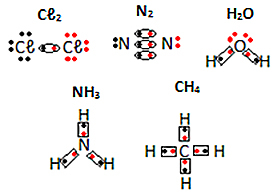
Ve vzorci Lewis, každý sdílený elektronový pár představuje chemickou (kovalentní) vazbu, kde se elektrony setkávají v oblasti elektrosféry, která je společná pro každý pár atomů, které jsou spojeny dohromady. Proto jsou v reprezentaci umístěny vedle sebe.
Například zjistíme, jaký je Lewisův vzorec pro plynný vodík, jehož molekulární vzorec je: H2.
Každý atom vodíku má ve valenčním plášti pouze jeden elektron, protože tento prvek patří do rodiny 1 periodické tabulky. Každý potřebuje přijmout ještě jeden elektron, aby byl stabilní, se dvěma elektrony v K elektronovém obalu. Sdílejí tedy své elektrony a oba dostanou dva. Dívej se:
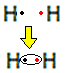
Toto je Lewisův vzorec pro molekulu plynného vodíku.
Kyslík má ve svém elektronovém obalu šest elektronů, takže každý musí přijmout dva další elektrony, aby byl stabilní, s osmi elektrony. Proto Lewisův vzorec pro molekulu kyslíku je:

Podívejte se, že existují dva odkazy, protože existují dva sdílené páry.
Viz další příklady elektronických vzorců molekulárních látek níže:
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Lewis Electronic Formula“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Zpřístupněno 28. června 2021.
Uhlíkový prostorový vzorec, Lewisův elektronový vzorec, rovinná struktura, elektronické páry, vazba kovalentní, valenční vrstva, vývoj atomového modelu, molekulární vzorec, strukturní vzorec, vzorce trojrozměrný.
Chemické vzorce, plochý strukturní vzorec, Couperův strukturní vzorec, trojná vazba, plyn dusík, elektronový vzorec, Lewisův vzorec, molekulární vzorec, jednoduchá vazba, dvojná vazba, plyn uhličitý.
Chemie
Molekulární látky, teplota varu, kontaktní povrch, bod varu, mezimolekulární přitahovací síly, chemická vazba, molekulární sloučeniny, kovalentní chemické vazby, iontové vazby, kovové vazby, fyzikální stavy špatný