Oxidačně-redukční reakce je charakterizována jako simultánní proces ztráty a zisku elektronů, protože elektrony ztracené atomem, iontem nebo molekulou jsou okamžitě přijímány ostatními.
Chcete-li pochopit, podívejte se na příklad:
Roztok síranu měďnatého (CuSO4 (aq)) je modrý kvůli přítomnosti Cu iontu2+ rozpuštěn v něm. Pokud dáme kovovou zinkovou desku (Zn(s)) v tomto řešení můžeme v průběhu času zaznamenat dvě změny: barva roztoku bude bezbarvá a na zinkové desce se objeví kovová měděná usazenina.
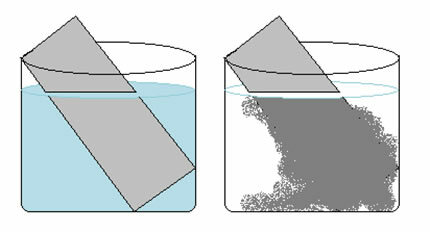
Reakce, která v tomto případě nastane, je tedy následující:
Zn(s) + CuSO4 (aq) → Cu(s) + ZnSO4 (aq)
nebo
Zn(s) + Cu2+(tady) + OS42-(tady) → Cu(s) + Zn2+(tady) + OS42-(tady)
nebo ještě
Zn(s) + Cu2+(tady) → Cu(s) + Zn2+(tady)
Všimněte si, že došlo k přenosu elektronů ze zinku na měď. Izolovanou analýzou transformace, ke které došlo v každém z těchto prvků, máme:
- Zn(s) → Zn2+(tady)
Zinek ztratil 2 elektrony přecházející z kovového zinku na kation. V tom případě, zinek prošel oxidací.
- Osel2+(tady) → Cu(s)
U mědi se stal pravý opak, získal 2 elektrony a přešel z kationu mědi II na kovovou měď.
Měď byla snížena.To vysvětluje pozorované dvě změny, protože roztok se stal bezbarvý, protože ionty mědi byly transformovány na kovovou měď, která byla uložena na zinkové desce.
Nepřestávejte... Po reklamě je toho víc;)
Protože došlo k současné ztrátě a zisku elektronů, je tato reakce příkladem redoxní reakce, a prostřednictvím toho můžeme vytvořit následující koncepty, které se opakují pro všechny ostatní reakce tohoto typ:

Nejreaktivnější kov prochází oxidacíV navrhovaném příkladu je tedy zinek reaktivnější než měď.
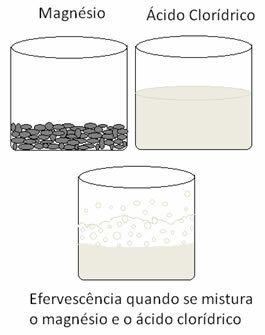
Další redoxní reakci, kterou lze citovat, nastává, když vložíme hořčík nebo hliník do roztoku kyseliny chlorovodíkové. V těchto reakcích vodík z kyseliny chlorovodíkové přijímá 3 elektrony z hliníku (nebo 2 elektrony z hořčíku) a předává je z H kationtu+ pro plynný vodík (H2), zatímco kov se stává kationem:
2 Al(s) + 6 hodin+(tady) → 2 Al3+(tady) + 3H2 (g)
mg(s) + 2 H+(tady) → Mg2+(tady) + H2 (g)
Kovy procházejí oxidací a vodík redukcí. Níže je uveden obrázek, který ukazuje, že přidání hořčíku k kyselině chlorovodíkové způsobuje a šumění, které je způsobeno uvolňováním plynného vodíku, a hořčík zmizí spotřebované.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Oxidační reakce“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Zpřístupněno 28. června 2021.
Chemie
Provoz airbagu, zařízení určené k ochraně řidičů, elektrický impuls, reakce chemického rozkladu, kolize, chemická směs azidu sodného, senzory umístěné na nárazníku automobilu, alkalický křemičitan, plyn dusík.
Chemie

Fotocitlivé čočky, oxidačně-redukční reakce, ztráta nebo zisk elektronů, fotosyntetické čočky ve slunečních brýlích, složení fotochromatického skla, čtyřboké atomy kyslíku, krystalová struktura chloridu stříbrného, ultrafialové světlo, stříbrný kov


