říkají si vnitřní přechodové prvky všech 28 chemické prvky nacházející se v 6. a 7. období skupiny 3 (nebo rodiny IIIB) v Periodická tabulka. Jsou umístěny konkrétněji mimo hlavní část tabulky.
se nazývají přechodové prvky protože nepatří do rodin A (reprezentativní prvky), ale nelze je zaměňovat s prvky vnějšího přechodu (prvky patřící do rodin B a umístěné v hlavní části tabulky Periodické).
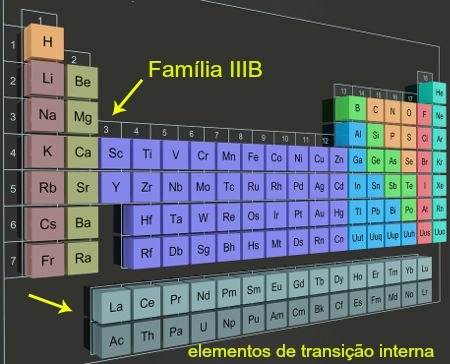
Interní přechodové prvky ve sloupcích umístěných mimo Periodickou tabulku
Vy vnitřní přechodové prvky prezentovat f sublevel jako energičtější. Důkazem toho je, že každý z vodorovných sloupců odkazujících na tyto prvky má pouze 14 prvků, přičemž 14 je maximální počet elektrony podporováno podúrovní f.
a) Série lanthanidů
Lanthanoidy jsou všechny ty, které patří výlučně do 6. období rodiny IIIB, a jsou tak pojmenovány, protože prvním prvkem v sérii je lanthan (La). Prohlédněte si jména a akronymy všech z nich:
Lanthan (La)
Cer (C)
Praseodymium (Pr)
Neodym (Nd)
Promethium (Pm)
Samarium (Sm)
Europium (I)
Gadolinium (Gd)
Terbium (Tb)
Dysprosium (Dy)
Holmium (Ho)
Erbium (Er)
Thulium (Tm)
Ytterbium (Yb)
Všechny vnitřní přechodové prvky představují podúrovni 4f jako nejenergetičtější, tj elektronická distribuce ze všech končí na této podúrovni, jak vidíme v distribuci dvou prvků patřících do série:
Nepřestávejte... Po reklamě je toho víc;)
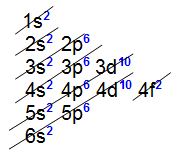
Elektronická distribuce lanthanidového prvku Cerium

Elektronická distribuce lanthanoidového prvku Holmium
b) Série aktinidů
Aktinidy jsou všechny ty, které patří výlučně do 7. období rodiny IIIB, a jsou tak pojmenovány, protože prvním prvkem v řadě je Actinium (Ac). Prohlédněte si jména a akronymy všech z nich:
Actinium (Ac)
Thorium (čt)
Protactinium (Pa)
Uran (U)
Neptunium (Np)
Plutonium (Pu)
Americium (Am)
Curium (Cm)
Berkelium (Bk)
Kalifornie (srov.)
Einsteinium (y)
Fermium (Fm)
Mendelevium (Md)
Nobelova (Nb)
Všechny vnitřní přechodové prvky představují podúrovni 5f jako nejenergetičtější, tj. Distribuci elektronika všech z nich končí na této podúrovni, jak vidíme na distribuci dvou prvků, které patří série:

Elektronická distribuce uranového aktinidového prvku

Elektronická distribuce kalifornského aktinidového prvku
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. "Interní přechodové prvky"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/elementos-transicao-interna.htm. Přístup 27. června 2021.