Do roku 1824 se věřilo, že postavené tepelné stroje mohou podstoupit funkčnost perfektní, to znamená, že se myslelo, že mohou dosáhnout 100% výnosu, nebo něco podobného hodnota. Jinými slovy, vědci v té době věřili, že mohou využívat veškerou tepelnou energii dodávané do těchto strojů - to znamená, že věřili, že mohou přeměnit veškerou tuto energii na práce.
Inženýr Sadi Carnot byl v té době odpovědný za předvádění demonstrací, při nichž nebylo možné získat 100% výnos. Sadi navrhl, aby ideální teoretický tepelný stroj pracoval v určitém cyklu, který se nyní nazývá Carnotův cyklus.
Na své demonstraci Carnot konceptualizoval dva postuláty, které byly navrženy ještě předtím, než byl vyhlášen první zákon termodynamiky. Podívejte se, co Carnotovy postuláty vyjadřují:
1. postulát Carnota
- Žádný stroj, který pracuje mezi dvěma stálými teplotami, nemůže přinést větší výkon než Carnotův ideální stroj, který pracuje mezi stejnými teplotami.
2. postulát Carnota
- Při provozu mezi dvěma teplotami stroj ideál Carnot má stejnou účinnost bez ohledu na provozní kapalinu a je zcela reverzibilní, bez přidání energie.
Podle postulátů, které uvedl Carnot, vidíme záruku, že účinnost tepelného motoru je funkcí teplot horkých a studených zdrojů. Stanovením teplot těchto zdrojů je však Carnotův teoretický stroj ten, který dokáže dosáhnout nejvyšší účinnosti.
Carnotův cyklus je idealizovaný, reverzibilní cyklus, ve kterém je provozní tekutinou dokonalý plyn, což odpovídá dvěma transformacím. izotermy to jsou dva adiabatický, proložené. Procesy popsané plynem v tomto cyklu jsou:
1.°) izotermická expanze DA, během kterého je plyn v kontaktu se systémem konstantní teploty TA (horký zdroj), který z něj přijímá množství tepla QA.
2.°) adiabatická expanze AB, během nichž nedochází k výměně tepla s okolním prostředím. Systém provádí práci se snížením vnitřní energie a tím i teploty.
3.°) BC izotermická kontrakce, během kterého je plyn v kontaktu se systémem konstantní teploty TB (zdroj chladu), což mu dodává množství tepla QB.
4.°) adiabatická kontrakce CD, během nichž plyn nevyměňuje teplo s okolním prostředím. Systém přijímá práci, která slouží ke zvýšení jeho vnitřní energie a tím i teploty.
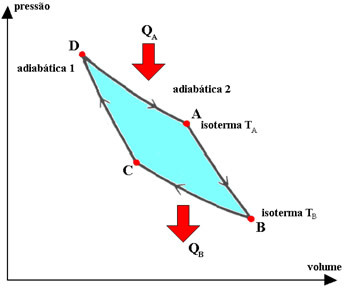
V Carnotově cyklu došlo k výměně tepla (QTHE a QB) a termodynamické teploty (T.THE a TB) teplých a studených zdrojů jsou úměrné, vztah je:

Dosazením v rovnici účinnosti tepelného stroje získáme pro stroj Carnot:
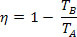
Vzhledem k teplotě studeného zdroje (TB) rovnající se nule kelvin (absolutní nula), máme η = 1 nebo η = 100%. Tato skutečnost je však v rozporu s druhým zákonem termodynamiky, který zaručuje příjem ve výši 100%, což nás vede k závěru, že žádný fyzický systém nemůže mít teplotu rovnou nule absolutní.
Autor: Domitiano Marques
Vystudoval fyziku
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/fisica/maquinas-carnot.htm
