О Диаграма на фазите е графика, използвана за обозначаване на температурни условия и натиск необходимо за получаване на вещество в определена физическо състояние (твърдо, течност или газообразни).
Представяне на фазова диаграма
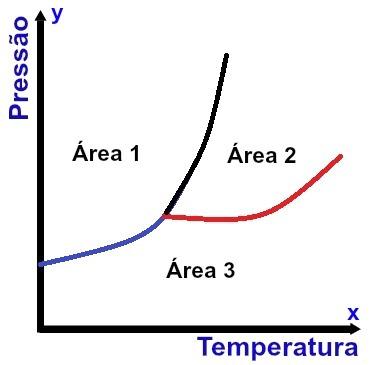
Оста x (хоризонтална) съдържа температурни стойности, а оста y (вертикална) съдържа стойности на налягането. Освен това има три криви, свързани към една точка (наречена тройна точка), разделяща графиката на три добре дефинирани области, както може да се види на диаграмата, показана по-горе.
В допълнение към посочване на условията за веществото да бъде в специфично физическо състояние, Диаграма на фазите показва условията за настъпване на всяка промяна във физическото състояние.
Промените във физическото състояние са:
Сливане: преход от твърдо в течно състояние;
Втвърдяване: преход от течно в твърдо състояние;
Изпаряване: преход от течно в газообразно състояние;
Кондензация: преход от газово в течно състояние;
Сублимация: преход от твърдо в газообразно състояние;
Пресублимация: преход от газ в твърдо състояние.
а) Региони
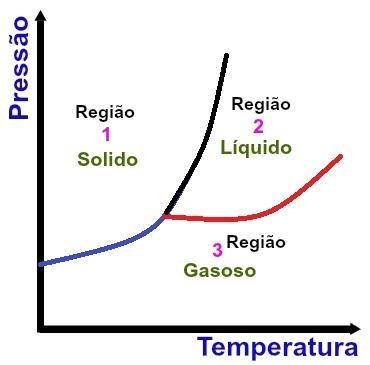
Основни области на фазова диаграма
Регион 1
Област 1 показва условията на температура и налягане, при които намираме веществото в твърдо състояние.
Регион 2
Регион 2 показва условията на температура и налягане, при които намираме веществото в течно състояние.
Регион 3
Регион 3 показва условията на температура и налягане, при които намираме веществото в газообразно състояние.
б) Криви

Криви, присъстващи във фазова диаграма
Крива А (лилава крива)
Това е кривата, която разделя твърдата и газообразната област на фазовата диаграма и обикновено се нарича крива на сублимация. Всяка точка, разположена на крива 1, показва, че имаме определено вещество, съжителстващо в твърдо и газообразно състояние.
Не спирайте сега... Има още след рекламата;)
В допълнение към индикацията за съвместно съществуване, крива 2 също така показва температурните и налягащите условия за превръщането на веществото от течно в газообразно състояние.
Крива B (черна крива)
Именно кривата разделя твърдата и течната област на фазовата диаграма и обикновено се нарича крива на втвърдяване. Всяка точка, разположена на крива 2, показва, че имаме определено вещество, съжителстващо в твърдо и газообразно състояние.
В допълнение към индикацията за съвместно съществуване, крива 2 също така показва температурните и налягащите условия за превръщането на веществото от течно в твърдо състояние.
Крива C (червена крива)
Това е кривата, която разделя твърдата и газообразната област на фазовата диаграма и обикновено се нарича крива на кондензация. Всяка точка, разположена на крива 3, показва, че имаме определено вещество, съжителстващо в твърдо и газообразно състояние.
В допълнение към индикацията за съвместно съществуване, крива 3 също така показва температурните и налягащите условия за превръщането на веществото от твърдо в газообразно състояние и обратно.
в) Тройната точка
Точката, където трите криви във фазовата диаграма се срещат, се нарича тройна точка. В този момент имаме температурната стойност и стойността на налягането, при които едновременно намираме веществото в твърдо, течно и газообразно състояние.

г) Промени на физическото състояние във фазовата диаграма
Във фазовата диаграма по-долу имаме 6 стрелки, които показват посоката на промените във физическите състояния на дадено вещество.

Стрелка 1: показва сливането
Стрелка 2: показва втвърдяване
Стрелка 3: показва изпаряване
Стрелка 4: показва конденз
Стрелка 5: показва сублимация
Стрелка 6: показва сублимация
От мен Диого Лопес Диас
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
ДНИ, Диого Лопес. „Какво е фазова диаграма?“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diagrama-fases.htm. Достъп на 28 юни 2021 г.
Химия

Течни трансформации, изпаряване, междумолекулни сили, течно супер замръзване, течна кристализация, закаляване, вискозитет на течността, налягане на течните пари, атмосферно налягане, замръзване на течността, температу
Химия

Течности, повърхностно напрежение, сливане на твърдо вещество, кондензация на газ, вискозитет, течност, постоянен обем, молекули на газ, междумолекулни сили, компресия, изпаряване на течност.