НА активираща енергия това е минималното количество енергия, необходимо за сблъсъка между частиците на реагентите, направен в благоприятна ориентация, за да се получи и да доведе до реакция.
Реакциите възникват само когато реагентите имат енергия за активиране (или минималната необходима енергия, която варира от реакция до реакция; или в количество или във форма) или когато им се доставя.
Например, когато металният натрий влезе в контакт с вода, той реагира бурно. Това означава, че енергийното съдържание на тези реагенти вече е достатъчно за протичане на реакцията.
В случай на включване на печка, реакцията на горене ще настъпи само ако поставим запалена клечка кибрит или друг източник на огън близо до газа, който се отделя от печката. Това означава, че в този случай е необходимо да се достави енергия на системата, така че тя да достигне енергията на активиране и реакцията да се осъществи.
В случай на самия фосфор, за да изгори, енергията на активиране се осигурява от триенето. Същото се случва и с запалки, които също се нуждаят от искра, която дава необходимата енергия за активиране за изгарянето на съдържащия се в тях газ.
Енергията за активиране може да бъде осигурена и от светлината, какъвто е случаят с разлагането на водородния прекис. Ето защо се съхранява в тъмни или непрозрачни бутилки.

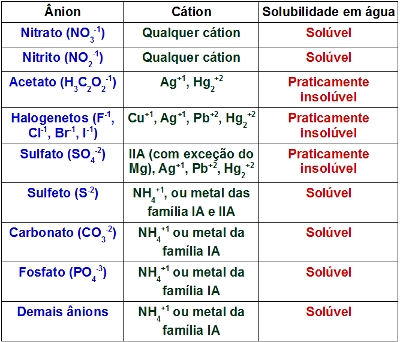
По този начин можем да заключим, че енергията на активиране (Eдо) е разликата между енергията, необходима за стартиране на реакцията (E), и енергията, съдържаща се в реагентите (Eпр):

Енергията на активиране е пречка за протичане на реакцията и е необходима за разкъсване на връзките на реагентите. С това протича реакцията и се създават нови връзки за образуване на продуктите.
Когато сблъсъкът между частици реагенти с благоприятна ориентация настъпва с равен или по-висока от енергията на активиране, преди образуването на продуктите се формира междинно и нестабилно състояние, деноминирани активиран комплекс, при което реагентните връзки са отслабени и се образуват продуктовите връзки. Поради това, активираща енергия е енергията, необходима за образуване на активирания комплекс.
По-долу имаме графика, която показва енергията на активиране като бариера за протичане на реакцията:
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/energia-ativacao.htm