За да настъпи химическа реакция е необходимо да се изпълнят четири основни условия, които са:
1. Реагентите трябва да се свържат;
2. Трябва да има химичен афинитет между реагентите;
3. Сблъсъците между частиците на реагентите трябва да бъдат ефективни;
4. Трябва да се достигне енергия за активиране.
Вижте накратко всеки случай:
1.Контакт между реагентите:
Това условие е очевидно, защото дори ако реагентите имат много афинитет един към друг, както в случая на киселини и основи, ако се разделят, реакцията няма да настъпи. Те трябва да влязат в контакт, така че техните частици да могат да се сблъскат, разкъсвайки връзките на реагентите и образувайки връзките на продуктите.

2.Химичен афинитет:
Както видяхме, привеждането на реагентите в контакт е необходимо, но не достатъчно. Например, ако поставим натрий в контакт с вода, ще се получи изключително бурна реакция, но ако сложим злато, няма да видим никаква разлика. Това е така, защото различните вещества имат различен химичен афинитет помежду си, или може изобщо да нямат афинитет. Колкото по-голям е химическият афинитет, толкова по-бърза е реакцията.
В споменатите примери натрият има голям афинитет към водата, толкова много, че за да не влезе в контакт с влагата във въздуха, метален натрий се съхранява в керосин. Златото е инертно, поради което златните паметници траят толкова дълго, като саркофазите в Египет.

3.Теория на сблъсъка:
Дори в съединения, които имат химически афинитет, за да протече реакцията е необходимо техните частици, атоми или молекули да се сблъскат ефективно. Не всички частици, които се сблъскват, правят това ефективно, но ударите, които водят до счупване на реагентните връзки и образуването на нови връзки са тези, които се случват в правилната ориентация и с енергията достатъчно.
По-долу е показан случаят на два неефективни сблъсъка и един ефективен сблъсък, който води до настъпване на реакцията.
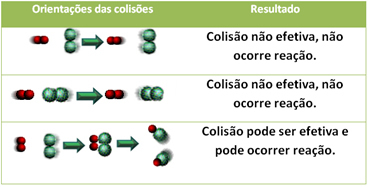
4.Енергия на активиране и активиран комплекс:
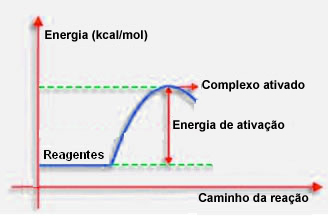
Както беше посочено в предходната точка, ефективният сблъсък, освен благоприятни насоки, се нуждае и от достатъчно енергия. Минималното количество енергия, необходимо за всяка реакция да се осъществи, се нарича енергия на активиране.
Ако реагентите имат енергия, равна или по-голяма от енергията на активиране, по време на добре ориентирания удар, ще се образува първоначално активиран комплекс, който е междинна структура между реагентите и продукти. В активирания комплекс има отслабени реагентни връзки и образуващи се нови продуктови връзки.
По този начин енергията на активиране работи като вид бариера за възникване на реакцията, защото колкото по-голяма е тя, толкова по-трудно ще бъде реакцията. В някои случаи е необходимо да се достави енергия на реагентите. Например, газът за готвене има афинитет да взаимодейства с кислорода във въздуха, но трябва да доставяме енергия, когато съберем кибритената клечка, в противен случай реакцията не се осъществява. Но след като започне, самата реакция отделя достатъчно енергия, за да активира останалите молекули и да поддържа реакцията.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm

