Има клон на науката, който изучава скоростта на химичните реакции и факторите, които влияят върху него, той се нарича Химическа кинетика. Химическите реакции могат да се определят като набор от явления, при които две или повече вещества реагират помежду си, пораждайки различни съединения. Химичното уравнение е графично представяне на химична реакция, където реагентите се появяват в първия член, а продуктите във втория.
A + B  C + D
C + D
Реактиви Продукти
Познаването и изучаването на реакциите, освен че са много важни в промишлено отношение, са свързани и с нашето ежедневие.
Скоростта на реакцията е колко бързо се консумират реагентите или колко бързо се образуват продуктите. Изгарянето на свещ и образуването на ръжда са примери за бавни реакции. В динамита разлагането на нитроглицерин е бърза реакция.
Скоростите на химичните реакции се определят чрез емпирични закони, наречени закони на скорост, изведена от ефекта на концентрацията на реагентите и продуктите върху скоростта на реакция.
Химичните реакции протичат с различна скорост и те могат да бъдат променени, тъй като в допълнение към концентрация на реагенти и продукти, скоростите на реакция зависят и от други фактори като:
Концентрация на реагента: колкото по-висока е концентрацията на реагентите, толкова по-бърза ще бъде реакцията. За да се осъществи реакция между две или повече вещества, е необходимо молекулите да се сблъскат, така че да има прекъсване на връзките с последващото образуване на нови. Броят на сблъсъците ще зависи от концентрациите на A и B. Вижте снимката:
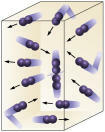
Молекулите се сблъскват по-често, ако
увеличаваме броя на реагиращите молекули.
Лесно е да се види, че поради по-висока концентрация ще има увеличаване на сблъсъците между молекулите.
контактна повърхност: увеличаването на контактната повърхност увеличава скоростта на реакцията. Пример е, когато разтваряме натрошена таблетка Sonrisal и тя се разтваря по-бързо отколкото ако беше цяло, това се случва, защото увеличаваме контактната повърхност, която реагира с Вода.
Налягане: когато увеличавате налягането в газообразна система, скоростта на реакция се увеличава.
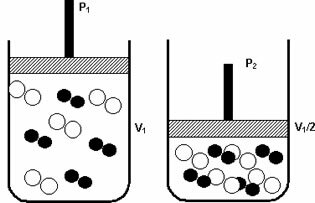
Увеличението на налягането от P1 до P2 намалява обема от V1 до V1 / 2, ускорявайки реакцията поради приближаването на молекулите.
Фигурата по-горе илюстрира, тъй като с намаляването на обема във втория контейнер ще има увеличение на налягане, усилващо сблъсъците на молекулите и като следствие увеличаване на скоростта на реакция.
Температура: когато температурата на системата е повишена, има и увеличаване на скоростта на реакцията. Увеличаването на температурата означава увеличаване на кинетичната енергия на молекулите. В нашето ежедневие можем да наблюдаваме този фактор, когато готвим, и увеличаваме пламъка на печката, така че храната да достигне степента на готвене по-бързо.
Катализатори: Катализаторите са вещества, които ускоряват механизма, без да бъдат трайно променени, тоест по време на реакцията те не се консумират. Катализаторите позволяват на реакцията да поеме алтернативен път, който изисква по-малко енергия за активиране, което кара реакцията да протича по-бързо. Важно е да запомните, че катализаторът ускорява реакцията, но не увеличава добива, т.е. произвежда същото количество продукт, но за по-кратък период от време.
От Лирия Алвес
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm


