активни изомери или оптично активни изомери (IOA) са молекули на определено химично вещество, които могат да осъществят поляризацията и отклонението на план на светлина надясно или наляво. За да проверите дали дадено вещество има активни изомери, просто проверете дали в неговата структурна формула има асиметричен въглерод:

Анализирайки веригата, представена на изображението по-горе, можем да видим, че централният въглерод има четири различни лиганди (ОН, Н, СН3 и Cl), което го прави a въглерод асиметрична, наричан още въглерод хирална. По този начин, когато веригата има един или повече хирални въглероди, ще има активни изомери.
Вие видове активни изомери(IOA) те са:
Десняк: Активен оптичен изомер, който огъва поляризираната светлина надясно;
Левогиро: Активен оптичен изомер, който огъва поляризираната светлина вляво.
Наблюдение: Наличието на асиметричен въглерод в структурна формула показва, че веществото трябва да има левовъртящ се изомер и правомерния изомер. Не зависи от нас да знаем по какъв начин светлината е била отклонена, тъй като наличието на хирален въглерод вече доказва този факт. Винаги половината от съществуващите молекули са левичари, а другата половина - десничари.
Левите и десните молекули на всяко органично вещество винаги имат едни и същи физични свойства (точка на топене, точка на кипене, плътност, разтворимост и др.), но присъстват химични дейности (поведение в организма) много различни. Пример за това е адреналинът. Само молекулата на адреналин левогира действа в организма, докато декстрогирата не действа.
Вижте сега структурната формула на веществото бутан-2-ол, за да проверите дали има активни изомери или не:
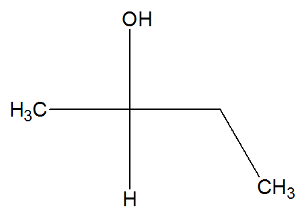
В структурата на бутан-2-ола можем да забележим, че въглеродът 2 има четири различни свързващи вещества (ОН, Н, СН3, СН2-CH3), така че е хирален въглерод и Представя десен въртящ се активен изомер и друг леворотационен активен изомер.
Изчисляване на активни изомери (IOA)
Холандският химик Jacobus Henricus van't Hoff разработи формула, която позволява да се изчисли колко активни изомери (IOA) може да представи дадено вещество. Виж:
IOA: 2не
н: е броят на хиралните въглероди в структурната формула на веществото.
Следвайте два примера за прилагане на формулата на Vant't Hoff:
5-дихлоро-2,3-дихидрокси-хександиоена киселина

В структурната формула на съединението има три хирални въглероди или асиметрични, следователно:
IOA = 2не
IOA = 23
IOA = 8
2,3,4,5-тетрахидроксихексанал

В структурната формула на съединението има четири хирални въглероди (червени стрелки) или асиметрични, следователно:
IOA = 2не
IOA = 24
IOA = 16
Наблюдение: Възможно е структурната формула да има два асиметрични въглерода, които имат абсолютно еднакви лиганди. Ако това се случи, ние вземаме предвид при изчисленията само 1 за стойността на n, а не 2. Вижте пример:
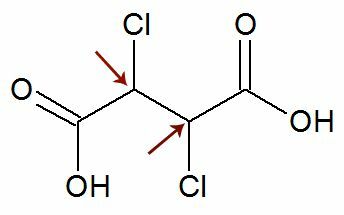
като два хирални въглерода те са равно на, ние разглеждаме само един въглерод в изчислението:
IOA = 2не
IOA = 21
IOA = 2
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm
