В лабораториите и химическата промишленост е много важно да се знае количеството вещества, участващи в реакциите. Следователно по-долу ще разгледаме основните понятия, величини и мерни единици, свързани с масите на атомите:
- Единица за атомна маса (u):
Стандартният референтен атом за определяне на атомната единица маса е въглерод-12 (12° С). Единица за атомна маса (1 u) съответства на стойността от 1.66054. 10-24 g, което е масата на 1/12 от въглеродния изотоп с маса, равна на 12 (12° С).
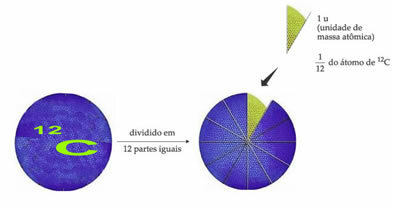
Единицата за атомна маса (u) е единицата, използвана във всички количества, изброени по-долу.
- Атомна маса на атом или изотоп (MA):
Получава се чрез сравняване с референтната стойност, спомената в предишния елемент. Например атомната маса на 919F се дава от масспектрометъра, който е равен на 18.9984 u. Закръглявайки се нагоре, той е равен на 19, което е същата стойност като неговото масово число (A). Тази стойност означава, че атомната маса на елемента 919F е 19 пъти по-голяма от масата на 1/12 от 12° С.
- Атомна маса на елемент (AM):
Атомната маса на елемента се определя от средно претеглената атомна маса на неговите изотопи. Това се прави чрез умножаване на атомните маси на всеки изотоп по процента, който се появява в конституцията на елемента. След това тези стойности се сумират, които се разделят на 100, което води до общия процент.
Например елементът неон е съставен от три изотопа със следните атомни маси и проценти в тяхната структура:

Изчисляване на атомната маса (MA) на този елемент:
ЛОШОнеон = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
ЛОШОнеон = 20 179 u
- Молекулярна маса (MM):
Както подсказва името, той се използва за молекулни вещества, тоест атоми, свързани чрез споделяне на двойки електрони, които се наричат ковалентни връзки.
Молекулната маса се получава чрез умножаване на броя на атомите на всеки елемент по техните атомни маси и сумиране на резултатите.
Например СО молекулата2 съдържа един въглерод и два кислорода, така че ще умножим атомната маса на въглерода по 1; и кислород с две, добавяйки ги по-късно:
ММCO2 = (1. ЛОШО° С) + (2. ЛОШОО)
ММCO2 = (1. 12) + (2. 16)
ММCO2 = 12 + 32
ММCO2 = 44 u
- Масова формула:
Същото е изчислението, извършено за молекулната маса, но за йонните съединения. В този случай името е различно, тъй като те не са групирани в молекули, а в клъстери от йони. Тъй като молекулите не съществуват, очевидно няма смисъл да се говори за молекулна маса, но мотивите зад изчислението са едни и същи.
Пример:
NaCl
↓ ↓
23 +35,5 → Формула маса = 58,5 u
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm

