Според френския химик Хенри Луи Льо Шателие, изместване на равновесието това е ситуация, при която химическата реакция се измества (напред или назад), когато е подложена на външно смущение. Това твърдение, предложено от химика, стана известно като принцип на Льо Шателие.
Забележка: директната реакция е тази, при която реагентите се трансформират в продукти, докато обратната реакция е тази, при която продуктите се трансформират в реактиви.
Реакцията е в равновесие, когато скоростта на директната реакция е същата като обратната реакция, т.е. реагентите се превръщат в продукти със същата скорост, в която продуктите се превръщат в реактиви.

Общо представяне на равновесна химическа реакция
Съгласно принципа на Льо Шателие, когато сила действа върху равновесна реакция, изместване на равновесието то ще се проведе, за да се отмени това смущение и да се установи нова равновесна ситуация в реакцията.
Смущенията, способни на изместване на химическия баланс те са:
→ вариране на концентрацията
когато концентрация в количество вещество
(в mol / L или молари) на участник в реакцията се променя (или намалява, или увеличава), изместване на баланса, стига този участник да не е в твърдо състояние.По този начин, съгласно принципа на Le Chatelier, ако концентрация ако участникът бъде увеличен, балансът ще се измести в посока, обратна на увеличението. Ако обаче концентрация участникът е намален, ще има изместване на баланса по посока на намаляването. Например:

Общо представяне на равновесна химическа реакция
Увеличаването на концентрацията на A = баланс се измества надясно
Намаляването на концентрацията на B = балансът се измества наляво
→ Вариация на натиск
Изменението на налягането само насърчава изместване в равновесие които имат газообразни компоненти, тъй като когато се увеличи, молекулите увеличават сблъсъците помежду си, а когато налягането намалява, те намаляват сблъсъците помежду си.
Сблъсъците между молекулите се увеличават с увеличаване налягане, защото обемът (пространството) се намалява съответно, като същевременно намалява натиск е придружен с нарастващ обем.
Забележка: В химическо равновесие, анализът на ефекта от модификацията на налягането взема предвид моларния обем на реагентите и продуктите, който обем е свързан с реакционните коефициенти. В уравнението по-долу обемът на реагента е 4, а продуктът е 2.
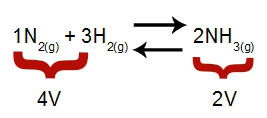
Уравнение, което показва обемите, присъстващи при образуването на амоняк
Съгласно принципа на Le Chatelier, ако налягането на дадена система се увеличи, изместването на баланс в посока на по-голям обем, докато ако налягането е намалено, изместването на баланс.

Уравнение, представляващо баланса на образуването на амоняк
Нарастващото налягане = балансът се измества надясно (защото това е страната с по-малък обем).
Намаляващото налягане = балансът се измества наляво (защото това е страната с по-голям обем).
→ Променливост на температурата
Увеличението на температура на равновесна реакция благоприятства молекулите да се сблъскват повече, докато намаляването на температуранамалява тяхната възбуда и следователно шоковете им. Тъй като повишаването на температурата винаги благоприятства реакцията ендотермичен (такъв, който абсорбира енергия).
Анализът на ефекта на температурата върху равновесието отчита главно ΔH на реакцията. Ако ΔH е положително, пряката реакция ще бъде ендотермична, докато обратната ще бъде екзотермична. Ако ΔH е отрицателно, дясното ще бъде екзотермично, а обратното - ендотермично.
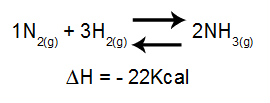
Уравнение, съдържащо вариация на енталпия в образуването на амоняк
Нарастващата температура = равновесието се измества наляво (защото това е посоката на ендотермичната реакция, тъй като ΔH е отрицателна).
Намаляването на температурата = равновесието се измества надясно (защото това е посоката на екзотермичната реакция, тъй като ΔH е отрицателна).
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm

