НА sp-тип въглеродна хибридизация това се случва само когато направи две pi връзки (π) и две сигма връзки (σ). В този случай тогава има две възможности: въглеродът може да направи две двойни връзки или единична и тройна връзка, както е показано по-долу:
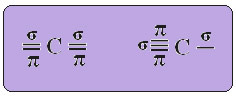
Текстът "sp тип хибридизация3”Показва подробно как протича въглеродната хибридизация. Запомняне: хибридизацията е „смесване“ на чисти атомни орбитали, които произхождат от хибридни атомни орбитали, еквивалентни една на друга, но различни от първоначалните чисти орбитали. И така, това се случва във въглеродните орбитали, които първоначално са били представени по следния начин:
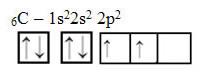
С получаването на енергия обаче електрон (представен със стрелка) от 2s орбиталата се повишава до 2p орбитала:
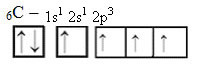
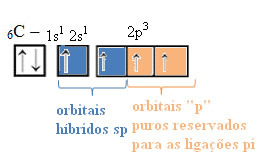
По този начин въглеродът има четири несдвоени орбитали, които могат да образуват четири ковалентни връзки, а не само две.
В случай на хибридизация от тип sp знаем, че две връзки ще бъдат pi; те се срещат в чистите „p“ орбитали, докато другите две орбитали, които са sp хибриди, ще направят останалите сигма връзки.
Пространственото представяне на тази хибридизация между s и p орбитала, пораждаща хибридна sp орбитала, може да бъде представено по следния начин:
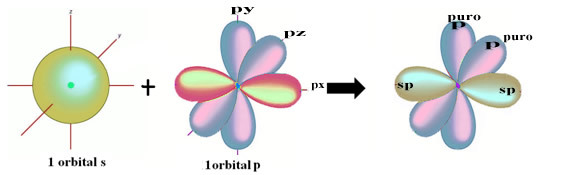
На фигурата по-горе е много ясно, че има две чисти орбитали, които ще направят връзките pi.
За да разберете как се случва това, нека вземем за пример молекула цианиден газ (HCN), използвана в САЩ в газови камери за затворници, осъдени на смъртно наказание. Неговата структурна формула се дава от:
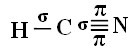
Що се отнася до въглерода, неговите атомни орбитали вече са показани, сега погледнете водородните и азотните орбитали:
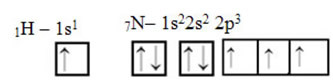
Обърнете внимание, че несдвоената водородна орбитала, която ще изпълнява сигма връзката, е „s“, която е пространствено представена от кръг; а азотните орбитали са от типа „p“, представени от три двойни яйцеклетки (всяка в пространствено поле: x, y, z). По този начин структурата на молекулата на HCN е представена по следния начин:
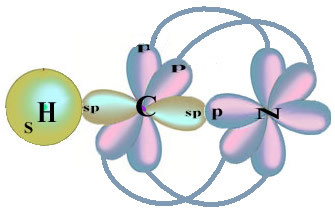
Що се отнася до вида връзки, съществуващи в тази формалдехидна структура, имаме:
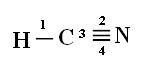
Връзки: 1 = σs-sp
2 = σp-sp
3 = 4 = πп-п
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
