В много лекарства и течни и твърди хранителни продукти, като оцет и бисквити, например съдържание в проценти маса на разтвореното вещество (m1) спрямо масата на целия разтвор (m = m1 + m2). Тази величина се нарича Заглавие (T) или масов процент на решение.
Дефиницията му може да бъде изразена по следния начин:

По този начин изчисляването му се извършва чрез математическото уравнение по-долу:
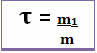
или

Тъй като и знаменателят, и числителят се занимават с една и съща единица (единицата за маса е грам - g), заглавието няма единица и е по-малко от 1.
По този начин, ако кажем, че заглавието на даден разтвор е 0,4, това означава, че за всяка единица маса на разтвора, 0,4 съответства на масата на разтвореното вещество. Заглавието обаче често се изразява като процент. За целта просто умножете намерената стойност по 100%. В този случай се нарича Масов процент (T%) *
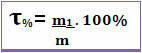
Обърнете внимание на фигурата по-долу, в която е даден тегловният процент натриев хлорид във физиологичен разтвор:

Физиологичният разтвор, използван за лечение на дехидратация, съдържа масов процент натриев хлорид 0,9%
В този случай това означава, че на всеки 100 g или 100 единици от този разтвор има 0,9 g или 0,9% разтворено вещество, т.е. натриев хлорид (NaCl - готварска сол).
Друг пример е оцетът: на етикета му има указание, че при приготвянето му са използвани 5% от масата на оцетната киселина, т.е. има 5 g от тази киселина на всеки 100 g разтвор.

Заглавието може да бъде дадено и в обемни проценти. В този случай единствената разлика е, че вместо да се свърже масата на разтвореното вещество с масата на разтвора; обемът на разтвореното вещество е свързан с обема на разтвора, съгласно следната формула:
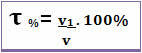
Например, в случай на обикновен алкохол, който има обемни проценти 96%, в 100 ml разтвор, 96 ml е алкохол.

* Терминът „Заглавие“ се използва по-често сред учените, докато техниците и няколко автори на книги използват израза „Масов процент“ по-често.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm
