НА автоокси-редукция или непропорционална реакция е вид окислително-редукционна реакция, при която се подлага на същия химичен елемент окисление и намаляване. Нека разгледаме два примера за този тип реакция и как да ги балансираме с помощта на редокс метода:
1-ви пример:
НА2- + Н+ → НЕ3- + НЕ + Н2О
- Чрез изчисляване на окислителните числа (NOX) на всички атоми и йони, участващи в реакцията, е възможно да се провери кой е окислил и кой е реагирал:
+3 -2 +1 +5 -2 +2 -2 +1 -2
НА2- + Н+ → НЕ3- + НЕ + Н2О
- Имайте предвид, че азотът е видът, който реагира и се окислява:
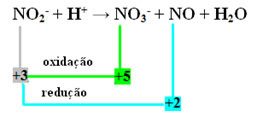
- За да извършим редокс балансирането на тази реакция, трябва да свържем NOX с продуктите, а не с реагентите:
НА3- = OxNox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Обръщайки ∆NOX по коефициентите, имаме:
НА3- = ∆NOX = 2 → 2 ще бъде коефициентът на NO
NO = ∆NOX = 1→ 1 ще бъде коефициентът на NO3-
НА2- + Н+ → 1 НА3- + 2 НЕ + Н2О
- С това вече знаем, че в продукта има 3 N, така че коефициентът на NO2- ще бъде 3:
3 НЕ2- + Н+ → 1 НЕ3- + 2 НЕ + Н2О
- За определяне на коефициентите на H + и от Н2О, не забравяйте, че броят на получените електрони е равен на същото количество подарени електрони; по този начин зареждането с реагент ще бъде равно на зареждането на продукта. По този начин можем да направим следната схема:
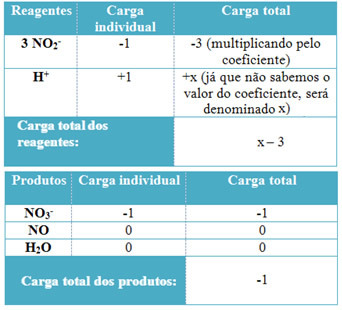
Въз основа на тази информация имаме, че общият заряд на реагентите е равен на х - 3 и продуктът е равен на -1. Както беше посочено, таксите на двамата трябва да бъдат равни. Тъй като вече имаме общото натоварване на продукти, можем да извършим просто изчисление, за да знаем каква ще бъде стойността на x:
x -3 = -1
x = -1 +3
x = 2
По този начин коефициентът на H+ е 2 и следователно тази на H2Ще бъде 1:
3 НЕ2- + 2 Н+ → 1 НЕ3- + 2 NO + 1 H2О
2-ри пример:
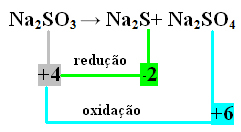
В този случай именно S претърпя редукция и окисление едновременно. По този начин, както беше направено по-рано, можем да свържем NOX с продуктите и да обърнем техните стойности, като им присвоим коефициентите:
В2 S = oxNox = 4 - (-2) = 6 → 6 ще бъде коефициентът на Na2 САМО4
В2 САМО4= ∆Nox = 6 - 4 = 2 → 2 ще бъде коефициентът на Na2 с
В2 САМО3→ 2 В2 Y + 6 В2 САМО4
Тъй като във втория крайник има 8 сяри, Na коефициентът2 САМО3 ще бъде 8:
8 инча2 САМО3→ 2 In2 S + 6 In2 САМО4
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm

