В ежедневието и в лабораториите има реакции и трансформации, които са спонтанни и други, които не са спонтанни. Например, цялото горене е спонтанна реакция, тъй като веднъж започнало, то ще продължи, докато се изразходва цялото гориво или докато изчезне целият кислород.
От друга страна, електролизата е неспонтанен процес, при който електрическата енергия се трансформира в химическа енергия. Пример за това е електролизата на натриев хлорид (NaCl). При преминаване на електрически ток върху тази разтопена сол има окислително-възстановителни реакции и образуването на метален натрий (Na(с)) и хлорен газ (Cl2 (g)). Ако спрем да пускаме електрическия ток, реакцията няма да продължи сама по себе си, което показва, че не е спонтанна.
Спонтанността на реакцията може да се измери с помощта на Уравнение на Гибс-Хелмхолц, дадено по-долу:

На какво:
∆G = изменение на свободната енергия;
∆H = промяна в енталпията;
T = температура в Келвин (винаги положителна);
∆S = промяна на ентропията.
Това уравнение носи името си, защото е предложено от американския физик Дж. Уилард Гибс (1839-1903) и от немския физик Херман Хелмхолц (1821-1894).
За да разберем по-добре как това уравнение ни помага да определим спонтанността на реакцията, нека прегледаме накратко всяка от концепциите, участващи в нея:
- ∆H (вариация на енталпията): Енталпия (Н) е енергийното съдържание на дадено вещество. Засега не е известен начин да се определи. На практика това, което се постига, е да се измери варирането на енталпията (∆H) на даден процес, като се използват калориметри. Тази промяна е в размер на енергия, която е била освободена или абсорбирана в процеса.
- ∆S (вариация на ентропията):Ентропия (S) е термодинамичното количество, което измерва степента на разстройство в системата.
Например при топене на лед молекулите преминават от твърдо в течно състояние, където има по-голяма дезорганизация. Това означава, че в този процес ентропията се е увеличила (∆S> 0).
При производството на амоняк (NH3), 1 mol азотен газ реагира с 3 mol водороден газ (т.е. 4 mol молекули в реагентите), което води до 2 mol амоняк:
н2 (g) +3 H2 (g) → 2 NH3 (g)
Тъй като броят на молекулите в газовата фаза намалява в този процес, дезорганизацията намалява, което означава, че ентропията също намалява (∆S <0).
- ∆G (Свободна енергия): Безплатна енергия или Безплатна енергия на Гибс (тъй като е предложено само от този учен през 1878 г.) е полезната енергия на системата, която се използва за извършване на работа.
Една система има глобална енергия, но само част от тази енергия ще бъде използвана за извършване на работа, това се нарича безплатна енергия на Гибс, символизирано от G.
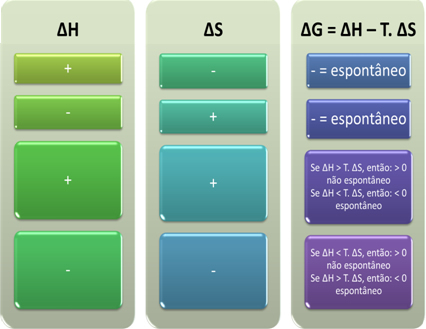
Според Гибс, процесът се счита за спонтанен, ако изпълнява работа, тоест ако G намалява. В този случай крайното състояние на трансформацията ще бъде по-стабилно от първоначалното при ∆G <0.
Въз основа на това можем да заключим следното:

Също така можем да видим дали процесът ще бъде спонтанен, като разгледаме алгебричния знак на ∆H и ∆S в уравнението на Гибс-Хелмхолц:
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
