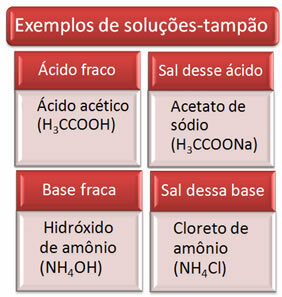
Буферният разтвор обикновено е смес от слаба киселина и солта на тази киселина или слаба основа и солта на тази основа. Този разтвор има за цел да предотврати появата на много големи вариации на pH или pOH на разтвор.
По-долу са дадени някои примери за буферни решения:
Ефективността на буферния разтвор може да се види в нашата кръв, където, дори с добавяне на киселина или основа в малки количества към кръвната плазма, практически няма промяна в неговото pH.
Как се случва това, като се има предвид, че ако добавим киселини или основи към водата, нейното рН се променя бързо?
Човешката кръв е малко основна буферна система, тоест тя е буферирана течност: нейното рН остава постоянно между 7,35 и 7,45. Един от най-интересните и важни буфери в кръвта се образува от въглеродната киселина (H2CO3) и от солта на тази киселина, натриев бикарбонат (NaHCO3).
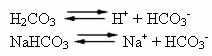
По този начин в този буферен разтвор има следните видове:
Н2CO3: присъства в големи количества, тъй като е слаба киселина, страда от малка йонизация;
Н+
HCO3-: също присъства във високи количества, от йонизацията на H2CO3 и дисоциация на солта (NaHCO3);
В+: от йонизацията на NaHCO3;
Ако към този разтвор се добави малка концентрация на киселина, ще се получи неговата йонизация, генерирайки Н катиони+, който ще реагира с HCO аниони3- присъства в средата с произход нейонизирана въглеродна киселина. Няма промяна в pH.
Ако се добави база, ще се генерират OH аниони-. Тези йони се комбинират с Н катиони+, от йонизацията на H2CO3. По този начин, OH анионите- се неутрализират, поддържайки рН на средата.
В допълнение към този споменат буферен разтвор, в кръвта има и други два, които са: Н2ПРАХ4/HPO42- и някои протеини. Ако няма такива буферни разтвори в кръвта, диапазонът на рН може да бъде сериозно изкривен. Ако рН на кръвта се повиши над 7,8, това се нарича алкалоза. Ако рН спадне твърде много, под 6.8, това ще бъде състояние на ацидоза. И двете са опасни състояния, които могат да доведат до смърт.

От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm
