Теорията на хибридизацията се появи като допълнение към Теория на октетите, успявайки да обясни структурата на по-голям брой молекули, включително молекули, образувани от бор (В).
Този елемент има пет основни електрона със следната електронна конфигурация:
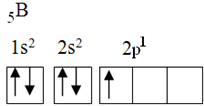
Според теорията на октета борът може да направи само една ковалентна връзка, тъй като има само една непълна атомна орбитала. Експериментално обаче се отбелязва, че този елемент образува съединения, в които осъществява повече от една връзка.
Пример е борният трифлуорид (BF3). Както е показано по-долу, борът прави три ковалентни връзки с флуор, споделяйки три двойки електрони и имащи шест електрона в последната му обвивка (валентен слой), т.е. изключение от правилото на октет.
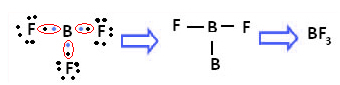
Това се обяснява с явлението хибридизация, което се случва с бор. Оказва се, че електрон от подниво 2s поглъща енергията и преминава в възбудено състояние, в което скача в празна орбитала от подниво 2р. По този начин се образуват три непълни орбитали, които вече могат да образуват три ковалентни връзки:
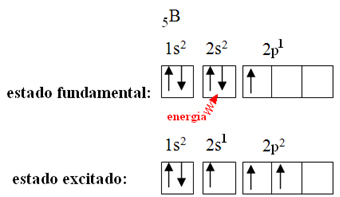
Обаче, връзките, образувани в бор трифлуорид, са еднакви, но ако погледнем по-горе, има две връзки различни, тъй като едната от тях ще бъде направена чрез s орбитала, а другите две чрез орбитала от типа. тип p. Тук се извършва хибридизацията, тоест непълните орбитали се сливат, пораждайки три хибридни орбитали или хибридизирани, които са идентични и различни от оригиналите:
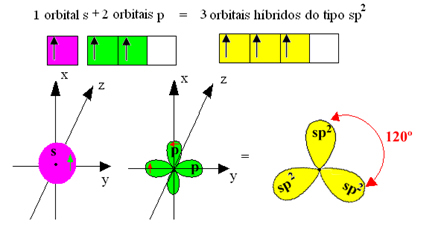
Тъй като тези хибридни орбитали се състоят от една s орбитала и две p орбитали, тази хибридизация се нарича sp² хибридизация.
Флуорът, който се свързва с бор, има девет електрона. Неговото електронно разпространение и орбитали са показани по-долу:
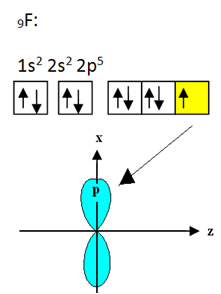
Обърнете внимание, че всеки флуорен атом може да направи само една ковалентна връзка и че орбиталата, която прави тази връзка, е от тип p. Така че, наблюдавайте по-долу как се формират орбиталите, когато правите връзките, които образуват BF3 и вижте как връзките са идентични, като σp-sp2:
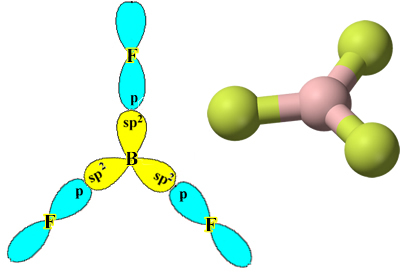
Това се случва и с други елементи, вижте например текста „Берилиева хибридизация”.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm


