Реакции на окисление-редукция, които протичат в присъствието на водороден прекис (воден разтвор на водороден прекис - Н2О2 (aq)) представляват специален случай, който трябва да се анализира отделно, главно по отношение на неговия баланс. Това е така, защото кислородите във водородния прекис, които имат Nox равен на -1, могат или да се окисляват, или да редуцират.
Например, нека разгледаме два случая, в които той се държи първо като окислител (редуциращ) и след това като редуциращ агент (окисляващ):
- окислител: винаги когато водородният прекис се редуцира, действайки като окислител, той генерира вода като продукт.
Ако добавим разтвор на водороден прекис към разтвор, съдържащ йодидни йони (I-) в кисела среда ще имаме:
Н2О2 (aq) + I-(тук) + Н+(тук) → H2О(1) + I2 (и)
Вижте, че се образуват вода и йод. Но за да проверите дали водородният пероксид действително е действал като окислител и редуциран, наблюдавайте определянето на окислителните числа (NOx): *

Кислородният Nox на водородния пероксид намалява от -1 на -2, като се има предвид, че той получава 1 електрон. Тъй като обаче имаме два кислорода във всяка молекула водороден прекис (H
2О2), вариацията на Nox ще бъде равна на 2.И така, както е показано в текста „Редокс балансиране”, Необходима стъпка за балансиране на реакциите чрез редокс метода е да се обърнат стойностите на вариациите на Nox чрез коефициентите, в този случай, както следва:
* H2О2 = 2 (∆Nox) = 2 → 2 ще бъде коефициентът на I-;
* Аз-= OxNox = 1 → 1 ще бъде коефициентът на H2О2.
По този начин имаме:
Един час2О2 (aq) + 2 I-(тук) + Н+(тук) → H2О(1) + I2 (и)
Постигане на останалите коефициенти чрез балансиране по опити:
- Тъй като в първия член има два кислородни атома, коефициентът на вода във втория член трябва да е равен на 2. И тъй като в първия член има и два йодидни йона, йодният коефициент във втория член ще бъде 1. Не забравяйте, че трябва да умножим индекса по коефициента, за да намерим правилното количество атоми и йони във всеки член:
Един час2О2 (aq) + 2 I-(тук) + Н+(тук) → 2 ч2О(1) + 1 I2 (и)
- Сега остава само да се балансира водородният катион на 1-ви член и неговият коефициент ще трябва да бъде равен на 2, тъй като във 2-ия член има 4 водорода, а в 1-ви член вече има два:
Един час2О2 (aq) + 2 I-(тук) +2 Н+(тук) → 2 ч2О(1) + 1 I2 (и)
- редуктор: винаги когато водородният пероксид се окислява, действайки като редуциращ агент, той генерира кислород (O2) като продукт.
Пример за намаляване на водородния прекис е когато той влезе в контакт с калиев перманганат (KMnO4). Това вещество има много характерен виолетов цвят, но когато влезе в контакт с водороден прекис, става безцветен. Това е така, защото целият манган, присъстващ в йона MnO4- от разтвора на перманганат се редуцира, като се получава йонът Mn2+, както е показано по-долу:
+1 -1 +7 -2 +1 0 +2 +1 -2
Н2О2 + MnO4-+ Н+ → The2 + Mn2++ Н2О
Изчислявайки Nox, виждаме, че кислородът във водородния пероксид всъщност се окислява и причинява намаляване на мангана:
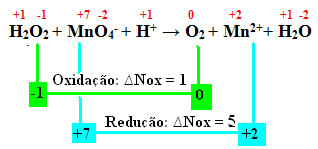
Както в предишния пример, oxNo на водородния прекис ще бъде равен на 2, тъй като има два кислорода и всеки от тях губи електрон. Следователно имаме:
* О2 = 2 (∆Nox) = 2 → 2 ще бъде коефициентът на MnO4-;
* MnO4- = ∆Nox = 5 → 5 ще бъде коефициентът на O2.
И като всички O2 идва от водороден прекис, двете вещества имат един и същ коефициент:
5 Н2О2 + 2MnO4-+ Н+ → 5 О2 + Mn2++ Н2О
Балансирайки чрез пробния метод, имаме:
5 часа2О2 + 2 MnO4-+ 6 Н+ → 5 O2 + 2 Mn2++ 8 Н2О
* За всякакви въпроси относно това как да се изчисли окислителното число (Nox) на атоми и йони в реакция, прочетете текста „Определяне на окислителното число (NOx)“.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm

