Обикновено реакциите на водна електролиза и магматична електролиза те се извършват с графитни и платинови електроди, които не участват в реакцията; те провеждат само електрически ток. Има обаче някои специфични случаи, когато е необходимо да се използва активни електроди, тоест, които претърпяват редукция и окисление.
Основните случаи на използване на тези електроди, които участват в редокс процеса, са: a електролитно пречистване на метали, като цинк, кобалт, никел и особено мед; а също и галванопластика. Нека да видим как се случва всеки случай:
• Медно електролитно пречистване: това електролитно рафиниране на мед може да доведе до чистота от около 99,9% и се използва главно за производство медни проводници, които, ако имат най-малко примеси, могат да имат способността да провеждат много електрически ток намалена.
Наблюдавайте как протича този процес, като видите схемата на електролитна вана, сглобена по-долу:

Потенциална разлика се прилага към водния разтвор на меден сулфат (CuSo4 (aq)
) - който провежда електричество - така че анодът, който е нечиста метална мед, губи електрони, т.е. претърпява окисление, освобождавайки своите катиони (Cu2+), които се отлагат върху отрицателната плоча. Това може да е инертна платинена плоча или, по-добре, чиста медна плоча. Той представлява катодът, който се редуцира при отлагане на мед в него. По този начин полуреакциите, възникващи в електродите, са: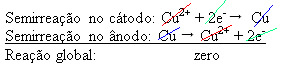
Фактът, че е дал нулев резултат, показва, че не е имало химическа реакция, а само транспорт на мед. На дъното на контейнера са останалите нечисти вещества, които са били в медта като злато, сребро, силициев диоксид (пясък) и други минерали, които дори могат да бъдат продадени.
• Галванопластика: метално покритие се нанася върху материал, който трябва да бъде защитен от корозия.
Металът, избран за покритието - който може да бъде хром (хромиране), никел (никелиране), сребро (сребро), злато (позлата) или цинк (поцинковане) - ще бъде анодът, положителен електрод, който претърпява окисляване, губейки електрони. Той претърпява окисляване на мястото на защитения материал, тъй като потенциалът му за намаляване е по-голям.
Отрицателният електрод, т.е. катодът, който приема тези електрони и претърпява редукция, е самият материал, който е бил покрит. По този начин той остава защитен, дори ако повърхността му по някакъв начин е нарушена.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm

